Bs Nguyễn Hoàng Kim Ngân -
Chảy máu là nguyên nhân hàng đầu gây tử vong trong phẫu thuật [1]. Trong bối cảnh chu phẫu, phẫu thuật kiểm soát thương tổn với các phác đồ truyền máu khối lượng lớn (MTPs) là tiếp cận điều trị được sử dụng trên lâm sàng để kiểm soát bệnh nhân bị chảy máu nặng. Truyền máu khối lượng lớn được định nghĩa một cách tùy ý là được truyền nhiều hơn 10 đơn vị khối hồng cầu trong 24 giờ. MTPs bao gồm các thành phần của máu hoặc máu toàn phần, cùng với các chất cô đặc yếu tố đông máu, bao gồm phức hợp prothrombin cô đặc (prothrombin complex concentrates-PCCs) và fibrinogen, và thường dựa trên một quy trình quản lý chảy máu có thể bao gồm tranexamic acid, thuốc tiêu sợi huyết [2]. Để hướng dẫn quản lý chảy máu, theo dõi đông máu bao gồm các xét nghiệm đông máu thường quy (vd, số lượng tiểu cấu, thời gian prothrombin và nồng độ fibrinogen), và/hoặc xét nghiện đo độ nhớt đàn hồi - viscoelastic testing (VET). Hỗ trợ cầm máu được dùng để tối ưu hóa quá trình cầm máu, trong khi bác sĩ phẫu thuật sửa chữa tình trạng chảy máu tại một vị trí cụ thể, một chiến lược đòi hỏi sự hợp tác giữa nhiều bác sĩ lâm sàng, ngân hàng máu, và hậu ccanf của bệnh viện. Trong đánh giá tổng quan này, chúng tôi sẽ xem xét tiếp cận điều trị để cầm máu trong quá trình chảy máu chu phẫu.
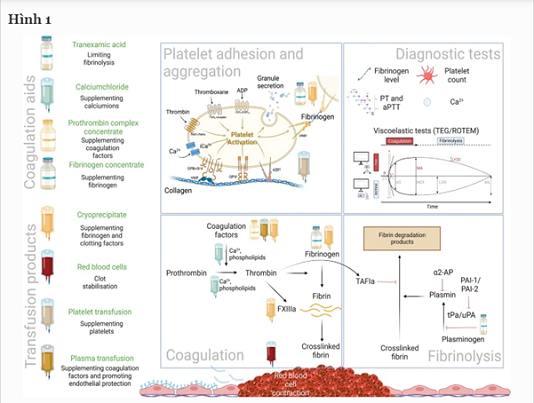
Hình 1. Hỗ trợ đông máu trong quản lý chảy máu chu phẫu. Mục tiêu của hỗ trợ đông máu trong quá trình kiểm soát chảy máu chu phẫu là thúc đẩy hình thành cục máu đông. Các thành phần của sự hình thành cục máu đông chính là fibrinogen được bổ sung bởi fibrinogen cô đặc và/hoặc kết tủa lạnh, tiểu cầu có thể được bổ sung bằng cách truyền tiểu cầu và được hoạt hoá bằng cách bổ sung canxi. Đối với quá trình đông máu thứ cấp, canxi, truyền huyết tương và phức hợp prothrombin cô đặc sẽ thúc đẩy quá trình hình thành thrombin và fibrin, giúp ổn định hơn nữa quá trình hình thành cục máu đông. Đáng chú ý, kết tủa lạnh chứa nhiều FXIII hơn hầu hết các chất cô đặc fibrinogen. Bằng cách kích hoạt thrombin, FXIII liên kết chéo các monome fibrin để tạo ra một mạng lưới polyme fibrin. Các tế bào hồng cầu tiếp tục củng cố sự ổn định của cục máu đông bằng cách thay đổi hình dạng của chúng. Có một số bằng chứng cho thấy việc truyền huyết tương, bên cạnh việc bổ sung yếu tố đông máu, còn bảo vệ quá trình giải phóng glycocalyx nội mô, hạn chế hình thành cục máu đông quá mức. Cuối cùng, axit tranexamic bằng cách liên kết các nhóm lysine của plasminogen hạn chế sự chuyển đổi plasminogen thành plasmin, làm giảm phản ứng tiêu sợi huyết.
Nguồn, liều dùng, và thời gian của Fibrinogen?
Fibrinogen, là một nó yếu tố cầm máu quan trọng để hình thành cục máu đông, nó được chuyển thành fibrin không hòa tan bởi thrombin sau khi liên kết với yếu tố VIII (Hình. 1). Các hướng dẫn khuyến nghị bổ sung fibrinogen để đạt mức 1,5–2 g/L trong quá trình chảy máu bằng cách sử dụng fibrinogen cô đặc hoặc kết tủa lạnh giàu yếu tố VIII [3]. Nguồn fibrinogen phụ thuộc sự sẵn có của từng quốc gia và các quy trình tại địa phương. Một thử nghiệm lâm sàng ngẫu nhiên (RCT) của phẫu thuật tim gần đây đã báo cáo là không có sự khác biệt khi sử dụng kết tủa lạnh hoặc fibrinogen cô đặc [4]. Tuy nhiên, không có dữ liệu thử nghiệm lâm sàng ngẫu nhiên nào ủng hộ nguồn fibrinogen ưa dùng, liều dùng, nồng độ fibrinogen mục tiêu tối thiểu, thời điểm bổ sung fibrinogen khi vẫn đang chảy máu.
Canxi ion hoá: có phải chỉ trung hoà citrat trong các chế phẩm máu?
Canxi ion hóa rất quan trọng cho quá trình đông máu (Hình 1). Truyền nhanh các chế phẩm máu được chống đông bằng citrate được chỉ định khi truyền máu khối lượng lớn-MTPs làm giảm canxi ion hoá cấp tính, ức chế các yếu tố đông máu phụ thuộc canxi. Các hướng dẫn đề nghị duy trì nồng độ canxi máu bình thường trong quá trình hồi sức [3]. Đáng chú ý, cần phải định lượng lại canxi đối trong hầu hết các xét nghiệm đông máu, cần xét đến sự mất canxi ẩn giấu và hạ canxi máu có thể xảy ra trong suốt giai đoạn hồi sức.
Phức hợp Prothrombin cô đặc-PCCs và các yếu tố đông máu cô đặc khác
PCCs thường chứa các yếu tố II, VII, IX, X, và protein C, S và antithrombin ở các nồng độ khác nhau (Hình 1). PCCs được phát triển để đảo ngược tác dụng của các kháng vitamin K [5], và ngày càng được sử dụng để kiểm soát chảy máu chu phẫu [2, 3]. Mặc dù PCCs có thể điều chỉnh rối loạn đông máu chu phẫu, nhưng những lo ngại về tính an toàn liên quan đến nguy cơ huyết khối tiềm ẩn [6]. Các yếu tố đông máu cô đặc khác được sử dụng bao gồm yếu tố VIIa tái tổ hợp và yếu tố XIII được sử dụng ngoài hướng dẫn (off-label) cho chảy máu kháng trị nhưng không được khuyến cáo bởi các guideline hiện nay.
Tranexamic acid
Các nghiên cứu thử nghiệm đa chấn thương báo cáo lợi ích của việc dùng thuốc chống tiêu sợi huyết Tranexamic acid (TXA) khi sử dụng sớm ở bệnh nhân chấn thương nặng. Tuy nhiên, mặc dù được sử dụng rộng rãi chỉ định cho chấn thương sọ não nặng (đơn thuẩn) [7] và xuất huyết tiêu hoá vẫn còn đang tranh cãi do khả năng tăng nguy cơ thuyên tắc huyết khối [8]. Ở những bệnh nhân chấn thương, do có mối lo ngại về việc sử dụng TXA ở những bệnh nhân đang ở giai đoạn ngừng tiêu sợi huyết, cần cân nhắc dựa trên các dữ liệu quan sát báo cáo về mối liên quan giữa TXA với giai đoạn ngừng tiêu sợi huyết và tỉ lệ tử vong. Tuy nhiên, theo Hướng dẫn của châu Âu, TXA được chỉ định một cách thường quy [2].
Truyền huyết tương: hỗ trợ thể tích tuần hoàn hay rối loạn đông máu?
Truyền huyết tương là một thành phần của MTPs, bao gồm huyết tương tươi đông lạnh (FFP) được thu nhận từ người hiến tặng nam hoặc huyết tương được làm sạch-hoà tan (solvent-detergent plasma - SDP) được thu thập từ các khối huyết tương, được xử lý để loại bỏ các loại virus có vỏ bọc, các vi hạt (microparticles) và các chất gây nhiễm khác. Các nghiên cứu RCT lớn so sánh các chế phẩm huyết tương trong giai đoạn chu phẫu còn thiếu. Huyết tương không điều chỉnh thời gian đông máu nhưng có thể giảm thiểu rối loạn nội mô trong quá trình hồi sức thể tích lớn, đây cũng là một lý do quan trọng cho việc sử dụng huyết tương [10]. Trong một thử nghiệm phẫu thuật tim thí điểm, SDP cho thấy giải phóng syndecan-1 ít hơn so với FFP [11]. Nhược điểm của việc truyền huyết tương liên quan đến tổn thương phổi cấp tính liên quan đến truyền máu (TRALI), quá tải tuần hoàn, sự nhiễm khuẩn và các phản ứng quá mẫn.
Tiểu cầu là thành phần cơ bản
Tiểu cầu rất quan trọng cho quá trình cầm máu. Dựa trên chiến luwocj truyền máu khối lượng lớn – MTPs, hồng cầu khối được chỉ định đầu tiên, sau đó là huyết tương, và tiểu cầu. Trong chảy máu do chấn thương, thử nghiệm PROPPR (The Pragmatic, Randomized Optimal Platelet and Plasma Ratios-Thử nghiệm pha III được thiết kế để đánh giá sự khác biệt về tỉ lệ tử vong trong 24 giờ và 30 ngày trong số các bệnh nhân được truyền máu khối lượng lớn) đã báo cáo tỉ lệ tiểu cầu:hồng cầu trong khoảng từ 1:1 đến 1:2 mà không có sự khác biệt về tỷ lệ tử vong giữa hai tỉ lệ được dùng. Hơn nữa, các thử nghiệm đánh giá thời gian và liều lượng truyền tiểu cầu ở bệnh nhân chấn thương vẫn còn thiếu. Hiện nay, tiểu cầu bảo quản lạnh đang được nghiên cứu bởi vì chúng có thời gian bảo quản kéo dài và ngày càng được nghiên cứu trong chảy máu chu phẫu. Nghiên cứu hiện tại cũng đang đánh giá các thành phần giống tiểu cầu tổng hợp như là những lựa chọn thay thế tiềm năng cho việc truyền tiểu cầu dị loại.
Khối hồng cầu: không chỉ để cung cấp oxy
Hồng cầu thay đổi thành hình đa diện khi được kết hợp vào cục máu đông đang hình thành, điều này được chứng minh làm tối đa sức bền của cục máu đông [12]. Hồng cầu tương tác với tiểu cầu, fibrinogen, yếu tố von Willebrand và FXIII để tối ưu hóa sự hình thành cục máu đông; tuy nhiên, vai trò của chúng trong quá trình đông máu thường bị bỏ qua khi xử trí chảy máu.
Hỗ trợ đông máu hướng đến cá nhân hoá
Liệu pháp hướng đến mục tiêu
Chiến lược truyền máu khối lượng lớn MTPs đưa ra sự hỗ trợ cho quản lý chảy máu chu phẫu, mặc dù các chiến lươc bổ sung khác là cần thiết. Ngoài các can thiệp thủ thuật và sửa chữa chảy máu bằng phẫu thuật, liệu pháp nhắm mục tiêu ngày càng được sử dụng cho chảy máu nặng. Là một phần của chiến lược này, các chiến lược truyền máu theo hướng dẫn của VTE làm giảm chỉ định truyền máu dị loại ở các bệnh nhân phẫu thuật tim. Tuy nhiên, các nghiên cứu so sánh VET với các xét nghiệm đông máu thường quy để hướng dẫn hỗ trợ truyền máu trong phẫu thuật ghép gan đã cho thấy nhiều kết quả khác nhau. Trong một nghiên cứu gần đây ở phẫu thuật ghép gan được hướng dẫn bởi VET, truyền hồng cầu và FFP giảm và không có sự khác biệt trong truyền tiểu cầu, nhưng chỉ định truyền kết tủa lạnh đã tăng lên [13]. Sau chảy máu do chấn thương, các chiến lược truyền máu theo hướng dẫn VET được so sánh với các xét nghiệm đông máu thường quy cũng đã được báo cáo là làm giảm tỷ lệ tử vong [14]. Tuy nhiên, chiến lược truyền máu với sự hỗ trợ đánh giá đông máu tăng cường bằng xét nghiệm VET không cải thiện khả năng sống hoặc làm giảm nhu cầu truyền máu khối lượng lớn. Hầu hết các nghiên cứu so sánh VET với xét nghiệm đông máu thường quy đều dùng phương pháp tiếp cận theo lưu đồ; tuy nhiên, những lợi ích có thể là do sử dụng cách tiếp cận dựa trên bằng chứng, theo lưu đồ để kiểm soát chảy máu, và tránh được việc sử dụng các chế phẩm máu theo kinh nghiệm. Bệnh nhân bị rối loạn đông máu mắc phải và đang chảy máu có thể được hưởng lợi nhiều nhất từ sự hỗ trợ đông máu theo mục tiêu như một phần của các thuật toán đã được thiết lập.
Thông điệp mang lại
Quản lý chảy máu chu phẫu hiện nay bao gồm cách tiếp cận đa phương thức gồm truyền máu khối lượng lớn MTP, tranexamic acid TXA, thuật toán truyền máu theo hướng dẫn của VET và các chế phẩm yếu tố đông máu cô đặc. Với tình trạng thiếu máu đang diễn ra, các yếu tố đông máu cô đặc là liệu pháp điều trị thay thế quan trọng để tạo thuận lợi cho quá trình cầm máu. Các sửa đổi bổ sung của các sản phẩm máu dị loại, bao gồm cả tiểu cầu bảo quản lạnh, có thể cung cấp thêm các yếu tố đông máu quan. Những nỗ lực liên tục để tối ưu hóa các chiến lược hỗ trợ truyền máu và điều chỉnh đông máu hiện tại của chúng tôi trong quá trình chảy máu hoạt động tiếp tục được đánh giá. Quản lý chảy máu chu phẫu trong tương lai có thể sẽ được cá nhân hóa và các nghiên cứu đang được tiến hành sẽ hướng dẫn các cách tiếp cận điều trị của chúng tôi.
Tài liệu tham khảo
- Roshanov PS, Eikelboom JW, Sessler DI, Kearon C, Guyatt GH, Crowther M, Tandon V, Borges FK, Lamy A, Whitlock R, Biccard BM, Szczeklik W, Panju M, Spence J, Garg AX, McGillion M, VanHelder T, Kavsak PA, de Beer J, Winemaker M, Le Manach Y, Sheth T, Pinthus JH, Siegal D, Thabane L, Simunovic MRI, Mizera R, Ribas S, Devereaux PJ (2021) Bleeding inde- pendently associated with mortality after noncardiac surgery (BIMS): an international prospective cohort study establishing diagnostic criteria and prognostic importance. Br J Anaesth 126:163–171.
- Rossaint R, Afshari A, Bouillon B, Cerny V, Cimpoesu D, Curry N, Duranteau J, Filipescu D, Grottke O, Grønlykke L, Harrois A, Hunt BJ, Kaserer A, Komadina R, Madsen MH, Maegele M, Mora L, Riddez L, Romero CS, Samama C-M, Vincent J-L, Wiberg S, Spahn DR, (2023) The European guideline on management of major bleeding and coagulopathy follow- ing trauma: sixth edition. Critical Care 27: 80. DOI
- Kietaibl S, Ahmed A, Afshari A, Albaladejo P, Aldecoa C, Barauskas G, De Robertis E, Faraoni D, Filipescu DC, Fries D, Godier A, Haas T, Jacob M, Lancé MD, Llau JV, Meier J, Molnar Z, Mora L, Rahe-Meyer N, Samama CM, Scarlatescu E, Schlimp C, Wikkelsø AJ, Zacharowski K (2023) Manage- ment of severe peri-operative bleeding: guidelines from the european society of anaesthesiology and intensive care: second update 2022. Eur J Anaesthesiol 40:226–304.
- Callum J, Farkouh ME, Scales DC, Heddle NM, Crowther M, Rao V, Hucke H-P, Carroll J, Grewal D, Brar S, Bussières J, Grocott H, Harle C, Pavenski K, Rochon A, Saha T, Shepherd L, Syed S, Tran D, Wong D, Zeller M, Karkouti K, Group ftFR (2019) Effect of fibrinogen concentrate vs cryoprecipitate on blood component transfusion after cardiac surgery: the fibres rand- omized clinical trial. JAMA 322:1966–1976.
- Goldstein JN, Refaai MA, Milling TJ Jr, Lewis B, Goldberg-Alberts R, Hug BA, Sarode R (2015) Four-factor prothrombin complex concentrate versus plasma for rapid vitamin K antagonist reversal in patients needing urgent surgical or invasive interventions: a phase 3b, open-label, non-inferiority, randomised trial. The Lancet 385:2077–2087.
- Bouzat P, Charbit J, Abback PS, Huet-Garrigue D, Delhaye N, Leone M, Marcotte G, David JS, Levrat A, Asehnoune K, Pottecher J, Duranteau J, Courvalin E, Adolle A, Sourd D, Bosson JL, Riou B, Gauss T, Payen JF,
- Group PS (2023) Efficacy and safety of early administration of 4-factor prothrombin complex concentrate in patients with trauma at risk of mas- sive transfusion: The PROCOAG randomized clinical trial. JAMA.
- Roberts I, Shakur-Still H, Aeron-Thomas A, Beaumont D, Belli A, Brenner A, Cargill M, Chaudhri R, Douglas N, Frimley L, Gilliam C, Geer A, Jamal Z,
- Jooma R, Mansukhani R, Miners A, Pott J, Prowse D, Shokunbi T, Williams J (2021) Tranexamic acid to reduce head injury death in people with trau- matic brain injury: the CRASH-3 international RCT. Health Technol Assess 25:1–76.
- Collaborators H-IT (2020) Effects of a high-dose 24-h infusion of tranexamic acid on death and thromboembolic events in patients with
- Bài dịch từ: Kleinveld, D.J.B., Curry, N. & Levy, J.H. Coagulation support during perioperative bleeding management. Intensive Care Med (2023).
Nguồn: Intensive Care Med //doi.org/10.1007/s00134-023-07089-6
- 25/06/2023 07:32 - Huyết tương giàu tiểu cầu tự thân
- 14/06/2023 21:11 - Hẹp tắc động mạch chủ bụng chậu dưới động mạch thậ…
- 10/06/2023 07:06 - U mô đệm ống tiêu hoá
- 31/05/2023 15:34 - Những bệnh thần kinh - cơ gây suy hô hấp
- 23/05/2023 17:41 - 5 nguyên tắc của nghiệm pháp nâng chân thụ động tr…
- 17/05/2023 18:57 - Tổng quan ung thư vú
- 16/05/2023 09:53 - Phẫu thuật sinh thiết cột sống ngực và thắt lưng q…
- 15/05/2023 09:59 - Hội chứng Sheehan
- 15/05/2023 09:33 - Bất thường nang tuyến phổi bẩm sinh (Congenital Pu…
- 13/05/2023 11:21 - Sinh lý cơ sở dịch truyền và nội mô mạch máu









