BsCK2 Trần Lâm
A. Một số đặc điểm của nhóm thuốc statin
Lịch sử của statin bắt đầu từ năm 1987 với thế hệ đầu tiên là lovastatin đã mở ra một cuộc cách mạng trong điều trị rối loạn lipid máu (RLLM). Statin là nhóm thuốc được kê đơn phổ biến nhất do hiệu quả làm giảm cholesterol toàn phần (TC) và LDL-C, sự dung nạp và tính an toàn tuyệt vời của nó. Nhóm thuốc này được chia thành 3 thế hệ:
- Thế hệ 1: do lên men hoặc bán tổng hợp, bao gồm lovastatin, simvastatin và pravastatin.
- Thế hệ 2: do tổng hợp racemic, gồm fluvastatin.
- Thế hệ 3: do tổng hợp đối quang, gồm cerivastatin (đã ngưng lưu hành) và atovastatin, rosuvastatin và pitavastatin.
Lovastatin, simvastatin, atovastatin, và cerivastatin được chuyển hóa hoặc chuyển dạng sinh học bởi hệ cytochrome P 450 (CYP) 3A4. Fluvastatin chuyển hoá bởi CYP2C9, riêng pravastatin ít được chuyển hoá bởi CYP. Pravastatin cực kỳ ưa nước so với những statin khác, fluvastatin có những đặc điểm lý - hoá trung gian.
Tác dụng quen biết của nhóm thuốc statin là ức chế cạnh tranh enzym 3- Hydroxy-3-MethylGlutaryl Coenzym A reductase (HMG-CoA reductase) làm ngăn cản chuyển HMG-CoA thành mevalonat cần thiết cho sự tổng hợp cholesterol nội sinh. Giảm nồng độ TC khởi kích sự gia tăng tổng hợp và bộc lộ thụ thể của LDL-C, do đó, tăng giáng hoá LDL-C dẫn đến giảm đáng kể nồng độ LDL-C lưu hành trong máu. Tất cả các statin đều làm giảm nồng độ LDL-C rất hiệu quả từ 25 đến 63% tuỳ theo liều. Trong đó, rosuvastatin làm giảm nồng độ TC và LDL-C mạnh nhất, và làm tăng HDL-C nhiều hơn so với bất cứ thuốc nào dùng đơn độc. Ngoài ra, statin ức chế sự tổng hợp apo B-100, làm giảm sự tổng hợp những lipoprotein giàu triglyceride, làm tăng apo-A1. Đáp ứng điều trị với các statin có thể thấy được trong vòng 1-2 tuần, đạt tối đa trong vòng 4-6 tuần, và duy trì trong suốt quá trình điều trị lâu dài. Từ trước đến nay, người ta vẫn coi đây là cơ chế ưu tiên của statin góp phần điều trị bệnh tim mạch.
Ngoài ra, nhóm thuốc này có hiệu quả làm giảm những biến cố thiếu máu cục bộ trong một số quần thể nguy cơ có những mức cholesterol khác nhau. Những thử nghiệm lâm sàng ở bệnh nhân (BN) có / hay không có bệnh động mạch vành (ĐMV) và với tăng / hay không tăng cholesterol máu đã chứng minh một cách chắc chắn statin làm giảm 30% nguy cơ tương đối những biến cố mạch vành chủ yếu, và những BN có nguy cơ ban đầu cao hơn sẽ hưởng lợi ích tuyệt đối lớn hơn. Thật vậy, ngoài hiệu quả làm giảm cholesterol, statin còn những cơ chế tác dụng khác rất có ích với nhiều tên gọi khác nhau là “tác dụng không lipid”, “tác dụng không phụ thuộc cholesterol”, hoặc “tác dụng đa hướng” (pleiotropic effect). “Tác dụng đa hướng” của statin bao gồm cải thiện rối loạn chức năng nội mạc (RLCNNM), tăng độ khả dụng sinh học của nitric oxid (NO), chống oxy hoá, ức chế những đáp ứng viêm, và ổn định mảng xơ vữa (hình 1).
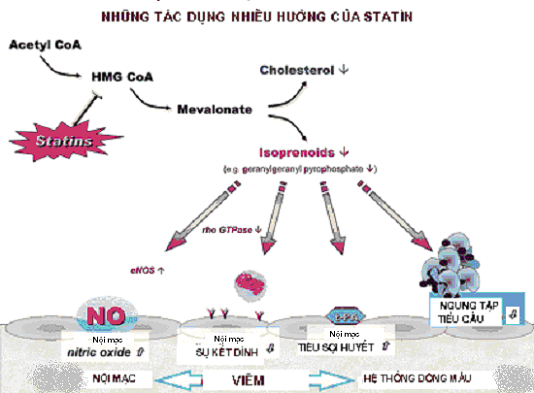
Hình 1. Những tác dụng đa hướng của statins
(Nguồn: Carl J. Vaughan et al (2004), “Update on Statin: 2003”, Circulation, 110, pp. 86-892).
B. Những tác dụng đa hướng của nhóm thuốc statin.
1. Tác dụng trên chức năng nội mạc.
Statin cải thiện chức năng nội mạc thông qua những cơ chế liên quan đến sự sản xuất NO và sự dãn mạch qua trung gian NO:
* Con đường qua trung gian Rho-kinase có một vai trò trung tâm trong RLCNNM và tăng co thắt của tế bào cơ trơn (TBCT) mạch máu. Sự bộc lộ và hoạt động của eNOS bị ức chế bởi Rho/Rho-kinase. Statin làm tăng hoạt tính của NO bằng cách trực tiếp ức chế Rho.
* Statin kéo dài độ ổn định của eNOS mRNA, làm tăng sự sao mã của eNOS, nên kéo dài thời gian nữa đời của eNOS.
* Do eNOS gắn vào những “hang nhỏ” trong tế bào mạch máu, tại đó eNOS bị phân huỷ. Statin ức chế được chất phân huỷ eNOS, và như vậy bảo vệ sự vững bền của eNOS.
* Statin tăng hoạt tính của t-PA, điều hoà sự tiết và tác dụng của những chất gây co mạch như ET-1, angiotensinn II nên làm giảm sức cản mạch máu, cải thiện dòng máu vành và hệ thống.
Nghiên cứu thực nghiệm cho thấy những con khỉ được điều trị bằng pravastatin có chức năng giãn mạch tốt hơn, ít đại thực bào (ĐTB) ở lớp áo trong và áo giữa hơn, ít canci hoá và ít tân sinh mạch máu ở lớp áo trong hơn so với những con chứng có cùng những biến đổi lipid tương tự.
Những nghiên cứu lâm sàng trên người đã chứng minh tác dụng của liệu pháp statin trên RLCNNM, ngay cả sau khi tác dụng hạ thấp lipid đã đạt đến tối đa; điều này chứng tỏ những tác dụng có lợi trên giường mạch của statin độc lập với tác dụng giảm cholesterol. Statin điều hoà lên sự tổng hợp NO của nội mạc, và cải thiện sự giãn mạch vành phụ thuộc nội mạc sau một tháng điều trị.
Nghiên cứu của Fabian và cs cho thấy simvastatin ảnh hưởng trên cả sự dãn mạch qua trung gian dòng chảy động mạch cánh tay (brachial artery Flow Mediated Dilation - FMD) và thiếu máu cục bộ cơ tim (TMCBCT) do gắng sức ở những bệnh nhân (BN) bị Hội chứng X của tim (HCXT) có tăng cholesterol máu. Egashira và cs nhận thấy sự dãn mạch phụ thuộc nội mạc của hệ thống vi mạch vành cải thiện nhanh chóng sau khi dùng L- arginin cho BN. Như vậy, RLCNNM trong HCXT có thể là do giảm tổng hợp hoặc do giảm phóng thích NO hoặc do cả hai.
2. Tác dụng chống stress oxy hoá
* Statin ức chế sinh xơ vữa bằng cách làm giảm sự tạo thành superoxide và những gốc oxy khác điều biến nhiều con đường tín hiệu nội bào.
* Statin điều hoà xuống sự bộc lộ của thụ thể LOX-1, và làm giảm tác dụng của oxLDL trên NF-B.
* Statin làm tăng hoạt động của chất chống oxy hoá liên quan với HDL-C là paraoxonase.
* Một số enzym hiện diện ở tổn thương xơ vữa có liên quan đến sự oxy hoá của LDL-C, bao gồm nicotinamide adenine dinucleotide (NADPH) oxidase, 12/15 lipoxygenase và NO synthase. Statin làm cho TBCT mạch máu giảm phát sinh gốc tự do bằng cách ức chế tiểu đơn vị p22phox và nox1 của NADPH oxidase.
3. Tác dụng ổn định mảng xơ vữa
* Sự hoạt động quá mức của MMP-9 dẫn đến sự phá huỷ bao xơ, mất ổn định và vỡ mảng xơ vữa. Statin ổn định mảng xơ vữa bằng cách ức chế sự tiết MMP-9.
* Fluvastatin và lovastatin làm giảm sự bộc lộ MMP-1 ở tế bào nội mạc (TBNM) mạch máu theo phương thức phụ thuộc thời gian và phụ thuộc liều
* Fluvastatin và pravastatin làm giảm sự bộc lộ MMP-1, MMP-2 và MMP-9 của ĐTB ở lớp áo trong của những con thỏ bị tăng lipid máu, và làm tăng sự sản xuất procollagen của TBCT.
* Pravastatin gây nên những biến đổi thuận lợi trên mảng xơ vữa động mạch cảnh ở người với ít ĐTB hơn, giảm hoạt động của MMP-2, và tăng hàm lượng collagen cao hơn.
4. Tác dụng ức chế tăng sinh tế bào cơ trơn
* Statin ức chế sự tăng sinh của TBCT và những hiện tượng khác dẫn đến tái cấu trúc mạch máu.
* Statin ức chế sự sản xuất của những sản phẩm mevalonate như là isoprenoids ảnh hưởng đến quá trình tăng sinh tế bào.
5. Tác dụng chống huyết khối
* Statin làm giảm sự bộc lộ của yếu tố mô (TF), làm giảm sự hoạt hoá tiểu cầu, sự biến dạng của hồng cầu, và cải thiện hoạt động tiêu sợi huyết bằng cách bảo tồn chức năng nội mạc.
* Statin làm giảm sản xuất thromboxan A2 , làm thay đổi mức cholesterol ở màng hồng cầu và màng tiểu cầu nên làm giảm khả năng tạo huyết khối của tế bào màng.
* Statin bình thường hoá sự sinh thrombin ở người bị tăng cholesterol máu, làm giảm kết dính tiểu cầu.
* Statin làm giảm nồng độ lipoprotein và fibrinogen huyết tương nên làm giảm độ nhớt của máu, do vậy cải thiện dòng máu vành đặc biệt là giường vi mạch.
* Statin làm giảm nồng độ của PAI-1 (vì nếu tăng sẽ có liên quan tới trạng thái prothrombin).
6. Tác dụng tân sinh mạch máu
Statin có thể thúc đẩy quá trình tân sinh mạch máu bằng cách huy động những tế bào tiền sinh nội mạc (EPC) thông qua sự kích thích con đường tín hiệu Akt/eNOS, làm giảm sự lão hoá và thúc đẩy sự tăng sinh dẫn đến gia tăng số lượng của chúng trong tuần hoàn của bệnh nhân bị bệnh ĐMV. Tế bào EPC di chuyển đến những vị trí tân sinh mạch máu và biệt hoá thành TBNM làm gia tăng quá trình tân sinh mạch máu của mô thiếu máu cục bộ. Mariuca Vasa và cs sử dụng atorvastatin liều 40 mg/ngày cho 15 BN bị bệnh ĐMV ổn định. Họ nhận thấy số lượng tế bào EPC trong máu ngoại biên của BN tăng gấp 1,5 lần sau 1 tuần, và gấp 3 lần sau 4 tuần điều trị. Ngoài ra, số lượng tế bào tiền sinh tạo máu (hematopoietic progenitor cell) cũng gia tăng đáng kể sau 4 tuần.
7. Tác dụng chống viêm.
Những tác dụng chống viêm trực tiếp có lẽ là phương thức hoạt động chủ yếu của nhóm thuốc statin, và độc lập với tác dụng giảm cholesterol của nó:
* Statin ức chế sự xâm nhập của tế bào đơn nhân (TBĐN) và tế bào T vào nội mạc mạch máu, ngăn chận sự biệt hoá TBĐN thành ĐTB, và thúc đẩy hiện tượng chết tế bào theo chương trình của TBĐN.
* Statin ức chế đặc hiệu sự hoạt hoá và sự bộc lộ yếu tố tiền viêm MCP-1 và TNF-α trong thành mạch. Tác dụng này liên quan với sự giảm hoạt hoá NF-B, là một yếu tố sao chép có liên quan với sự điều hoà bộc lộ E-selectin và sự trình diện của những cytokin tiền viêm khác như IL-1, TNF-a.
* Statin làm giảm sự bộc lộ ICAM-1 của ĐTB, làm giảm sự chế tiết IL-6, TNF- a và IL-1b của TBĐN.
* Những statin ưa lipid cũng làm giảm sự bộc lộ và sự hoạt động của TF ở ĐTB có nguồn gốc TBĐN.
* Statin trực tiếp ức chế sự tham gia của phức hợp hoà hợp tổ chức chủ yếu loại II (major histocompatibility complex class-II, MHC-II), và như vậy, nó hoạt động như là yếu tố kiềm hãm sự hoạt hoá tế bào T qua trung gian của MHC- II.
* Statin làm giảm nồng độ hs-CRP có lẽ thông qua nhiều cơ chế: @ Gia tăng tốc độ thanh thải hoặc làm giảm sự tổng hợp / bài tiết của CRP, @ Làm giảm IL-1b, IL-6, và TNF-a dẫn đến giảm tổng hợp CRP. Cuối cùng, sẽ làm giảm mọi hoạt động của CRP trong quá trình viêm và XVĐM.
Như vậy, những rối loạn điều hoà miễn dịch trong xơ vữa động mạch (đặc trưng bởi sự tăng sản xuất interferon...bởi tế bào T) tương tự như trong một số bệnh tự miễn (viêm khớp dạng thấp, lupus ban đỏ...), và do statin có tác dụng điều hoà miễn dịch nên các nhà miễn dịch học đã đề nghị xếp XVĐM vào nhóm bệnh tự miễn đặc hiệu cơ quan (organ-specific autoimmune disease).
TÀI LIỆU THAM KHẢO
- Allan R. Brasier et al (2002), “Vascular inflammation and the renin-angiotensin system”, Arteriosclerosis, Thrombosis, and Vascular Biology, 22(8), pp. 1257-70.
- Blake GJ, Ridker PM (2001), “Novel clinical markers of vascular wall inflammation”, Circulation, 89, pp. 763-80.
- Carl J. Vaughan et al (2004), “Update on Statin: 2003”, Circulation, 110, pp. 886-892.
- Carl P. Sparrow et al (2001), “Simvastatin has antinflammatory and antiatherosclerotic activities independent of plasma cholesterol lowering”, Arteriosclerosis, thrombosis and vascular biology, 21, pp.115.
- David C. Crossman (2004), “The pathophysiology of myocardial ischemia”, Heart, (90), pp. 576-580.
- David J. Maron et al (2000), “Current perspectives on statin”, Circulation. 101, pp. 2077.
- Deepak L. Bhatt, Eric J. Tipol (2002), “Need to test the arterial inflammation hypothesis”, Circulation, 106, pp. 136.
- Dirkje W. Sommeijer et al (2004), “Anti-inflammatory and anticoagulant effects of pravastatin in patients with type 2 diabetes”, Diabetes Care, (27), pp. 468-473.
- Ennio Ongini et al (2004), “NO-releasing statin derivatives, a class of drugs showing enhanced antiproliferative and inflammatory properties”, PNAS, pp. 8497-8502.
- Evans M (2004), “Medical lipid-regulating therapy: current evidence, ongoing trials and future developments”, Drugs, 64 (11), pp.1181-96.
- Faergeman O (2004), “Evolution of statin therapy: an ongoing story”, European Heart Journal, pp. 3-7.
- Hognestad A et al (2004), “Effects of conventional and aggressive statin treatment on markers of endothelial function and inflammation”, Clinical Cardiology, 27 (4), pp. 199-203.
- Jean Davignon (2004), “Benificial cardiovascular pleiotropic effects of statin”, Circulation, 109, pp. 39-43.
- Jiang Li, Shui P. Zhao et al (2004), “Early effect of pravastatin on serum soluble CD40L, matrix metalloproteinase-9, CRP on patients with acute myocardial infarction”, Clinical Chemistry, (50), pp. 1696-99.
- Joukhadar C et al (2001), “Similar effects of atorvastatin, simvastatin and pravastatin on thrombogenic and inflammatory parameters in patients with hypercholesterolemia”, Thromb Haemost, 85 (1), pp. 47-51.
- Juan Carlos Kaski (2004), “Pathophysiology and management of patient with cardiac syndrome X”, Circulation, 20, pp. 25-31.
- Julie K. Plenge et al (2002), “Inflammation reduced after just two weeks on statin drug”, Circulation, pp. 82-89.
- 18. Mariuca Vasa et al (2001), “Increase in circulating endothelial progenitor cells by statin therapy in patients with stable coronary artery disease”, Circulation, 103, pp. 2885-89.
- Michael R. Ehrenstein et al (2005), “Statins for atherosclerosis - As good as it gets ?”, NEJM, 352, pp. 73-75.
- Patrick Vallance, Norman Chan (2001), “Endothelial function and nitric oxide: clinical relevance”, Heart, 85, pp. 342-350.
-
Paul E. Szmitko, Chao-Hung Wang et al (2003), “New markers of inflammation and endothelial cell activation”, “Biomarkers of vascular disease linking inflammation to endothelial activation”, Circulation,108, pp. 1917-27, 2041-51.
- Sidney C. Smith et al (2004), “CDC/AHA workshop on markers in inflammation and cardiovascular disease”, Circulation, 110, pp. e550-e553.
- 01/10/2012 11:54 - Tác động của lipid máu lên nguy cơ bệnh lý vi mạch…
- 21/09/2012 15:05 - Tế bào gốc trong phục hồi tim - Các tiến bộ gần đâ…
- 20/09/2012 21:41 - Vai trò siêu lọc máu trong Hồi Sức Tích Cực-Chống …
- 20/09/2012 08:58 - Ung thư thực quản
- 19/09/2012 08:40 - Phân độ X quang trong bệnh lý trào ngược bàng quan…
- 15/09/2012 09:13 - Ung thư biểu mô phổi
- 14/09/2012 21:02 - Hội chứng hoạt hóa đại thực bào
- 13/09/2012 20:59 - Một cách nhìn khác về cắt tầng sinh môn
- 12/09/2012 12:43 - Chấn thương ngực
- 08/09/2012 20:10 - Dự phòng huyết khối thuyên tắc ở bệnh nhân phẫu th…









