TS Phan Đồng Bảo Linh - Nội TM
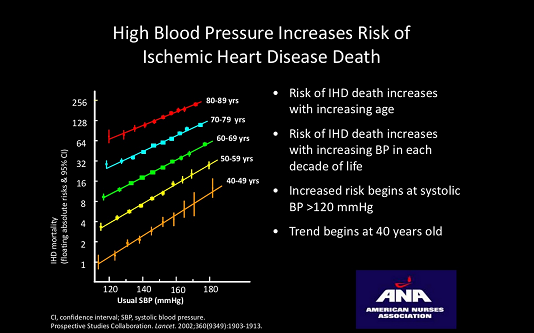
Các nghiên cứu dịch tễ học đã xác minh có sự kết hợp mạnh mẽ giữa tăng huyết áp và bệnh ĐMV. Tăng huyết áp là yếu tố nguy cơ độc lập lớn cho phát triển bệnh ĐMV, đột quỵ và suy thận. Sự lựa chọn tối ưu của thuốc hạ áp vẫn còn gây tranh cãi và mới chỉ có một phần câu trả lời cho câu hỏi quan trọng này trong điều trị tăng huyết áp để phòng ngừa và quản lý bệnh tim thiếu máu cục bộ:
- Các mục tiêu huyết áp tâm thu và huyết áp tâm trương thích hợp là gì ở bệnh nhân với bệnh ĐMV đã xác lập?
- Phải chăng những tác dụng có lợi của điều trị chỉ đơn thuần là chức năng hạ huyết áp (HA), hoặc là các dòng thuốc cụ thể này có hoạt động duy nhất bảo vệ ngoài ra có kết hợp thêm làm hạ HA?
- Là loại thuốc hạ huyết áp đặc biệt nào có thể hiện hiệu quả trong phòng ngừa thứ phát bệnh tim thiếu máu cục bộ?
- Những loại thuốc chống THA nào nên được sử dụng ở bệnh nhân có bệnh ĐMV với cơn đau thắt ngực ổn định, ở những người hội chứng vành cấp, trong đó bao gồm đau thắt ngực không ổn định, nhồi máu cơ tim không ST chênh lên và nhồi máu cơ tim ST chênh lên và trong những bệnh nhân suy tim do bệnh ĐMV?
CƠ CHẾ TĂNG HUYẾT ÁP VÀ BỆNH ĐỘNG MẠCH VÀNH
Một loạt các cơ chế sinh lý bệnh góp phần sinh bệnh của THA và liên quan tổn thương cơ quan đích, bao gồm ĐMV. Những cơ chế này bao gồm tăng hoạt hệ thần kinh giao cảm và hoạt động hệ RAA; thiếu hụt trong việc phóng thích hoặc hoạt động kém của các yếu tố giãn mạch. Ví dụ, oxit nitric và prostacyclin và những thay đổi trong nồng độ peptide lợi niệu thải natri; tăng biểu lộ các yếu tố tăng trưởng và các cytokine viêm trong cây động mạch; ảnh hưởng huyết động; bất thường chức năng và cấu trúc các động mạch truyền dẫn và kháng trở, đặc biệt tăng độ cứng động mạch và rối loạn chức năng nội mô. Những con đường thần kinh hocmon tương tác với các yếu tố di truyền, nhân chủng và môi trường (như tiếp xúc hoặc phản ứng cao các stress tâm lý, chế độ ăn uống quá nhiều natri và chế độ ăn uống không đầy đủ kali và canxi) để xác định liệu một người có thể phát sinh bệnh THA và bệnh ĐMV liên quan. Rối loạn chuyển hóa đồng thời, Ví dụ, đái tháo đường, kháng insulin và béo phì, cũng dẫn đến việc sản xuất adipocytokin vận mạch thúc đẩy sự co mạch, rối loạn chức năng nội mô, viêm và tăng stress oxy hóa trong các mạch máu, do đó tăng cả HA và nguy cơ bệnh tim mạch. Những cơ chế sinh lý bệnh cùng chia sẻ cung cấp các mục tiêu điều trị mới tiềm năng để phòng và điều trị THA và cả bệnh ĐMV với lợi ích có thể còn đi xa hơn nữa không đơn thuần là hạ HA.
1.1 Di truyền học
Nghiên cứu di truyền xác định nhiều biến thể nhạy cảm di truyền đa gene, chủ yếu là đa hình nucleotide đơn, như bệnh xơ vữa động mạch. Đã được đề xuất là đa hình gene của hệ RAA, đặc biệt là ACE, receptor type 1 của angiotensin II và angiotensinogen, liên quan đến phát triển bệnh ĐMV và NMCT. Sự hiện diện của THA làm tăng thêm nguy cơ bệnh mạch vành và có thể giải thích tại sao một số cá nhân có nhiều nguy cơ mắc hơn những người khác về bệnh mạch vành. Một số đa hình gene cũng liên quan với việc đáp ứng HA trong điều trị hạ huyết áp. Ví dụ, đa hình gen mã hóa cho các metalloproteinase matrix hiện diện cho cải thiện kết cục bệnh tim mạch ở bệnh nhân THA điều trị bằng chlorthalidone, amlodipine, hoặc lisinopril. Những dữ liệu này cho thấy rằng trong tương lai, việc xác định các biến thể di truyền có thể được sử dụng cho lựa chọn thuốc hạ áp thích hợp nhằm giảm cả HA và các nguy cơ bệnh ĐMV. Tuy nhiên, vì bệnh ĐMV và nguyên nhân của nó là đa yếu tố sinh bệnh, nghiên cứu di truyền chỉ giải thích một phần nhỏ trong khả năng di truyền của bệnh.
1.2 Các cơ chế vật lý và huyết động học
Trong bệnh THA vừa tăng nhu cầu tiêu thụ oxy cơ tim vừa giảm lưu lượng vành hoặc ít nhất giảm dự trữ vành. Nhu cầu tiêu thụ oxy tăng do tăng hậu gánh làm sức căng thành tim tăng, cũng như phì đại thất trái nếu có. Giảm dự trữ vành có thể do tắc nghẽn mạch vành bởi mảng xơ vữa, tái cấu trúc mạch vành vừa và nhỏ, HATTr thấp giảm áp lực tưới máu mạch vành.
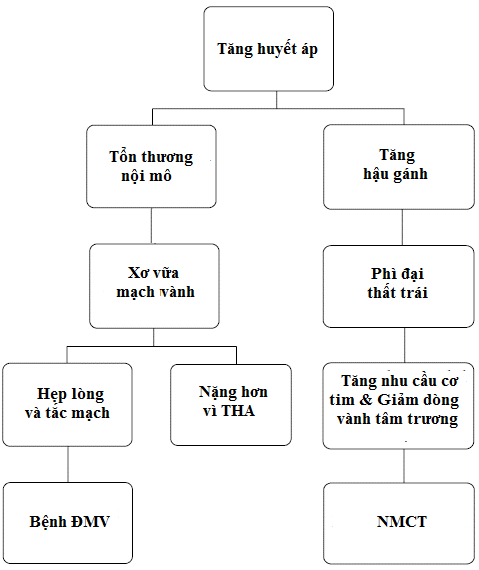
Cơ chế tổn thương động mạch vành
Các lực vật lý (áp suất và lưu lượng) là những yếu tố quyết định chính cho hoạt động chức năng và cấu trúc tim, cũng như ảnh hưởng đến quá trình tái cấu trúc và xơ vữa ĐM. HATT tăng, tăng trở kháng đường ra thất trái vừa tăng sức căng thành tim, làm tăng nhu cầu oxy cơ tim. Mở rộng khoảng ALM (pulse pressure) và THA tâm thu ở bệnh nhân lớn tuổi gần như luôn do trở kháng ĐMC cao không thích hợp. Trở kháng cao do đường kính ĐMC giảm hoặc do dày thành, biến đổi tăng cứng thành ĐMC. Quá trình lão hóa làm giảm và phá vỡ tính đàn hồi mạch máu, tăng lắng đọng collagen. Quá trình thoái hóa hiện rõ hơn ở bệnh nhân THA tâm thu đơn độc. HATT không giống nhau ở các ĐM do thay đổi đặc tính cấu trúc, chức năng liên quan lan truyền và dội lại của sóng mạch. HATT trung tâm bị ảnh hưởng đặc biệt bởi sóng phản hồi. Lực sóng này tăng dần theo tuổi và những thay đổi cấu trúc thành ĐM. Tăng dội lại của sóng làm tăng HATT trung tâm, tăng gánh thất và công cơ tim, dần dần gây phì đại thất trái và ĐTN. Những người sớm bị THA hoặc HA bình thường cao, sức căng thành mạch tăng phá vỡ và bẻ gãy các sợi đàn hồi, cũng như tăng lắng đọng collagen trong ĐM. Hậu quả giảm co giãn mạch máu. Những bất thường cấu trúc, rối loạn chức năng nội mạc do lão hóa và THA góp phần tăng CĐM ở người cao tuổi làm tăng ALM và THA tâm thu đơn độc sau này. CĐM (tăng vận tốc và sóng phản xạ) làm tăng hậu gánh và HATT trung tâm, đồng thời giảm HATTr giảm áp lực tưới máu vành. Tăng HATT ĐMC trung tâm do lão hoá, bệnh THA và/ hoặc bệnh ĐM, làm tăng đáng kể công cơ tim, bệnh tim liên quan áp lực bao gồm cả bệnh ĐMV và phì đại thất trái.
1.3. Rối loạn chức năng nội mô
Rối loạn chức năng nội mô, đặc trưng bởi mất cân bằng giữa các yếu tố giãn mạch, ví dụ oxit nitric và prostaglandin E1 với các yếu tố co mạch, ví dụ, endothelin và angiotensin II, là yếu tố góp phần quan trọng đến mức HA cao ở những người bị bệnh mạch máu. Các lớp nội mạc bị tổn thương mất khả năng giãn mạch và góp phần sinh huyết khối và tắc mạch máu. Phóng thích các cytokine hoạt động hóa học và các phân tử bám dính bề mặt của các tế bào nội mô lòng mạch thúc đẩy bám dính của bạch cầu đơn nhân và di trú vào thành mạch. Quá trình viêm mạch tự tồn tại và phân độ thấp này là cơ sở cho quá trình xơ vữa động mạch. Chất trung gian viêm kích hoạt tế bào cơ trơn trung mạc, làm cho chúng tăng sinh và di chuyển vào các khoảng dưới nội mạc. Trong sự hiện diện của rối loạn lipid máu, tế bào mono trong thành mạch nuốt lipoprotein cholesterol oxy hóa mật độ thấp, trở thành đại thực bào chứa đầy lipid, cốt lõi của các mảng bám xơ vữa động mạch. Trong các tổn thương thành lập, các đại thực bào thường trú tiết ra metalloproteinase và cathepsins, gây bất ổn vỏ xơ của các mảng bám, có thể dẫn đến vỡ mảng bám và phóng thích các yếu tố mô gây huyết khối, tắc mạch vành và NMCT cấp. Rối loạn chức năng nội mô và giảm oxit nitric sẵn có liên quan đến tổn thương cơ học và viêm của động mạch cũng đồng thời liên quan với tăng độ cứng động mạch và sự phát triển của THA tâm thu đơn độc. Một sự suy giảm trong chất trung gian giãn mạch phụ thuộc dòng chảy có khả năng góp phần làm giảm oxit nitric dẫn xuất nội mô xảy ra trong quá trình lão hóa và bệnh mạch máu không triệu chứng. Các yếu tố giãn mạch dẫn xuất nội mạc sút giảm chịu trách nhiệm cho THA do tập luyện gắng sức quá mức đã thấy trong các nhóm dân.
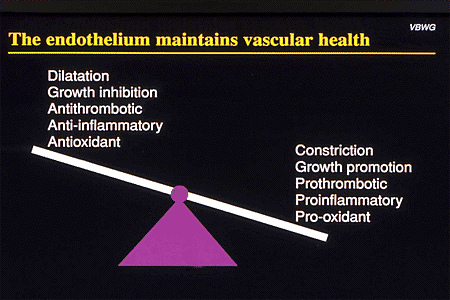
1.4 Stress oxy hóa
Stress oxy hóa là đặc tính quan trọng trong bệnh THA và bệnh sinh xơ vữa. Phát sinh quá mức các gốc oxy phản ứng (reactive oxygen) làm tổn hại các tế bào nội mô hay tế bào cơ, dẫn đến thay đổi cấp thời cũng như lâu dài cấu trúc, chức năng.
Các quá trình này gây bất thường cấu trúc vi tuần hoàn gặp trong THA mạn. Ở mô mạch máu, các tác nhân chính gây tổn thương oxy hóa là những chất oxy hóa NAD(P)H, chất này được kích hoạt bởi các lực cơ học (ví dụ THA), các hormon (đặc biệt là angiotensin II), cholesterol oxy hóa và các cytokine. Khi các tế bào được kích hoạt, những chất oxy hóa này dễ làm phát sinh anion peoxide (O2-). O2- dễ dàng phản ứng với oxide nitric tạo thành peroxynitrite (ONOO-) là chất chuyển hóa gây độc và rút ngắn thời gian nửa vòng đời nội mô, nơi sản sinh oxide nitric. Các gốc oxy phản ứng (reactive oxygen) như hydrogen peroxide và ONOO- nhanh chóng oxy hóa lipid, gây xơ vữa nhiều hơn và gây thay đổi kiểu hình như tăng sinh tế bào cơ trơn mạch máu, bộc lộ phân tử bám dính và gây lão hóa tế bào mạch máu. Nhiều chất đồng dạng oxy hóa NAD(P)H gây bộc lộ lớp tế bào cơ trơn mạch máu và nội mô, làm tăng quá trình xơ vữa và tổn thương ĐM.
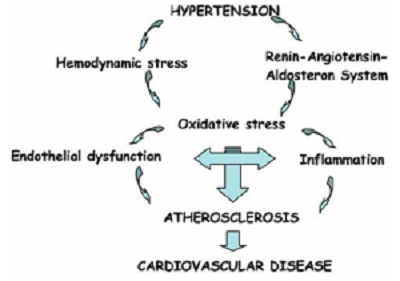
1.5 Các yếu tố chuyển hóa và thể dịch
Các cơ chế THA cũng là các cơ chế gây tổn thương cơ quan đích, bao gồm mạch vành và cơ tim. Những cơ chế này gồm tăng hoạt hệ thần kinh giao cảm và hệ renin-angiotensin-aldosterone (Hệ RAA); giảm phóng thích hoặc giảm hoạt các chất giãn mạch, ví dụ oxide nitric, prostacyclin và các peptide lợi niệu; các bất thường cấu trúc và chức năng ĐM, đặc biệt rối loạn chức năng nội mô; tăng các yếu tố tăng trưởng và cytokin gây viêm trong hệ thống ĐM. Dựa vào các cơ chế đó, các loại thuốc hạ áp mang lại hiệu quả có lợi trên mạch máu thông qua tác dụng hạ áp độc lập.
Angiotensin II gây THA và tổn thương cơ quan đích, trong đó có xơ vữa động mạch bởi rất nhiều cơ chế. Angiotensin II tác dụng trực tiếp lên sự co thắt và đề kháng thành mạch, tổng hợp và phóng thích aldosterone, tăng hoạt hệ thần kinh giao cảm và tăng catecholamine từ tuyến thượng thận và đầu tận cùng hệ thần kinh giao cảm ngoại biên. Aldosterone tác động giống hoặc làm tăng độc tính lên mạch máu của angiotensin II và norepinephrin. Angiotensin II trực tiếp xúc tiến quá trình phì đại tế bào cơ trơn mạch máu và tim thông qua hoạt động của thụ thể 1 của angiotensin II (AT1) và gián tiếp qua kích thích một số yếu tố tăng trưởng và cytokine, ví dụ như yếu tố tăng trưởng tiểu cầu, yếu tố tăng trưởng nguyên bào sợi, yếu tố tăng trưởng insulin-like và yếu tố tăng trưởng β chuyển đổi và các thụ thể cũng như protein-1 gây hóa hướng động tế bào đơn nhân và phân tử-1 bám dính tế bào mạch máu. Cuối cùng, mối liên quan giữa kích hoạt hệ RAA và ly giải fibrin. Angiotensin II gây hình thành chất ức chế-1 hoạt hóa plasminogen qua tác động phụ thuộc thụ thể AT1 lên tế bào nội mô, trong khi ACE (men chuyển) giảm hoạt hóa sản xuất plasminogen mô bằng giảm Bradykinin, đây là một chất kích thích mạnh hoạt hóa plasminogen nội mô.
Thuốc ức chế men chuyển và ức chế thụ thể Angiotensin cho thấy hiệu quả làm giới hạn phản ứng oxy hóa mạch máu bằng ngăn hoạt hóa chất oxy hóa NAD(P)H, do đó ức chế hệ RAA ngoài tác dụng hạ áp, còn có tác dụng bảo vệ mạch máu. Hơn nữa, có bằng chứng liên quan giữa hệ RAA và rối loạn lipid máu. Tăng cholesterol máu làm tăng hoạt hệ RAA, nhất là tăng hoạt động và mật độ thụ thể AT1 mạch máu và tăng tổng hợp Angiotensin II hệ thống. Hệ RAA cũng gây lắng đọng LDL-C ở thành ĐM.
1.6. Canxi
Ion canxi (Ca 2+) là chất trung gian nội bào chính của việc co rút tế bào cơ trơn mạch máu và chức năng co giãn của tim. Ca 2+ đi vào tế bào cơ trơn mạch máu, tế bào cơ tim và tế bào tạo nhịp tim thông qua kênh canxi type T và L phụ thuộc điện thế. Trong cơ trơn mạch máu, các kênh (kích hoạt chậm, hoạt động kéo dài) type L cổng điện thế cho phép thu nạp đủ Ca 2+ cho việc bắt đầu co lại bởi Ca 2+ nội bào phụ thuộc canxi phóng thích từ lưới cơ tương (sarcoplasmic). Tăng Ca2+ nội bào cũng có tác dụng thúc đẩy xơ vữa ĐM.
Thuốc ức chế kênh canxi dihydropyridine gắn với tiểu thể α1 của kênh canxi type L, chọn lọc cao đối với mô ĐM/ vi ĐM, bao gồm ĐMV, nơi chúng được xem là chất giãn mạch. Thuốc chẹn kênh canxi nondihydropyridine, bao gồm các phenylalkylamine (verapamil-like) và benzothiazepines (diltiazem -like), liên kết với các vị trí khác trên tiểu thể α1 và ít lựa chọn cho mô mạch máu; Chúng có tác dụng giảm tần số tim và tốc độ dẫn truyền trên mô dẫn truyền nút xoang nhĩ và nhĩ thất, tác động giảm co cơ của tế bào cơ tim. Các thuốc chẹn kênh canxi nondihydropyridine có tác động lớn hơn trên nút nhĩ thất so với nút xoang nhĩ và có thể ảnh hưởng đến block nhĩ thất mức độ cao ở bệnh nhân bệnh nút nhĩ thất đã có từ trước hoặc khi được kê với các thuốc khác, ví dụ, β-blockers, làm suy nút nhĩ thất. Cả hai nhóm ức chế kênh canxi được chỉ định điều trị THA và đau thắt ngực. Tác dụng chống đau thắt ngực của thuốc chẹn canxi là do giảm hậu gánh, đó là do chúng làm giảm huyết áp tâm thu, cũng như giãn mạch vành và trong trường hợp của ức chế kênh canxi nondihydropyridine, làm chậm nhịp tim. Ức chế kênh canxi là đặc biệt hiệu quả trong điều trị đau thắt ngực do co thắt động mạch vành, ví dụ, các biến thể Prinzmetal hoặc đau thắt ngực do lạnh.

2. Huyết áp mục tiêu
2.1 Tóm tắt huyết áp mục tiêu
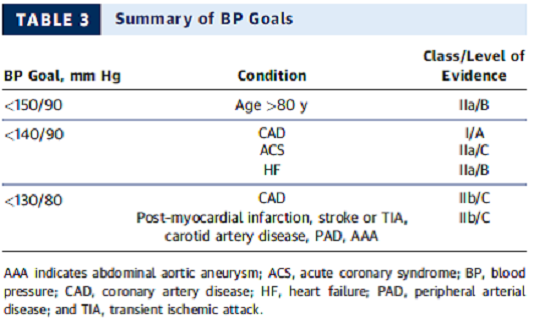
2.2 Kiến nghị
- HA mục tiêu < 140/90 mm Hg là hợp lý cho phòng ngừa thứ phát các biến cố tim mạch ở bệnh nhân tăng huyết áp và bệnh ĐMV (Class IIa; Chứng cứ cấp: B).
- Mục tiêu HA thấp hơn (<130/80 mm Hg) thích hợp trong một số cá nhân với bệnh ĐMV, NMCT trước đó, đột quỵ hoặc cơn thiếu máu thoáng qua, hay tương đương nguy cơ bệnh ĐMV (bệnh động mạch cảnh, bệnh động mạch ngoại biên, phình động mạch chủ bụng) (Class IIa; Cấp chứng cứ: B).
- Ở những bệnh nhân có HA tâm trương cao và bệnh ĐMV với bằng chứng của thiếu máu cục bộ cơ tim, HA nên hạ xuống từ từ và lưu ý cũng được khuyên trong việc giảm HA tâm trương đến <60 mmHg ở bất kỳ bệnh nhân đái tháo đường hay người > 60 tuổi. Ở người tăng huyết áp già hơn áp lực mạch đập mỡ rộng, hạ huyết áp tâm thu có thể gây ra các giá trị huyết áp tâm trương rất thấp (<60 mm Hg). Điều này nên cảnh báo bác sĩ lâm sàng để đánh giá cẩn thận bất kỳ dấu hiệu hoặc triệu chứng không thuận lợi, đặc biệt những kết quả từ thiếu máu cơ tim (Class IIa; Cấp chứng cứ: C).
(Còn tiếp)
Từ “A Scientific Statement from the American Heart Association, American College of Cardiology, and American Society of Hypertension”.
- 29/05/2015 14:50 - Động kinh trong chấn thương sọ não
- 29/05/2015 14:21 - Sử dụng kháng sinh điều trị sepsis
- 21/05/2015 15:37 - Phân loại mô học của u màng não
- 05/05/2015 07:46 - Điều trị tăng huyết áp ở bệnh nhân bệnh độ…
- 25/04/2015 16:14 - Can thiệp mạch vành cho bệnh nhân cao tuổi - Lợi í…
- 12/04/2015 06:27 - Colistin: sự trở lại của kháng sinh nhóm polymycin…
- 06/04/2015 08:42 - Đánh giá nhanh kết quả khí máu động mạch
- 06/04/2015 08:22 - Stent phủ thuốc Everolimus hay mổ bắt cầu cho …
- 31/03/2015 11:50 - Nhân 06 trường hợp dây rốn thắt nút trên lâm sàng
- 27/03/2015 15:56 - Các thuốc ức chế bơm proton (PPI)









