Bs Trần Quốc Chiến - Khoa Ung Bướu
Nguồn: Handbook of cancer chemotherapy (ấn bản lần 7)
Ở Mỹ, mỗi năm có 165.000 trường hợp tử vong do ung thư biểu mô phổi. Điều này tương ứng với 1/3 tổng số trường hợp tử vong do ung thư và nhiều hơn số trưòng hợp tử vong do ung thư vú, đại tràng và tiền liệt tuyến gộp lại. Ung thư phổi bao gồm 4 loại mô học chính: ung thư biểu mô tuyến, ung thư biểu mô tế bào vảy, ung thư biểu mô tế bào lớn và ung thư biểu mô tế bào nhỏ. Bởi đặc điểm sinh học duy nhất của ung thư phổi tế bào nhỏ (SCLC- small cell lung cancer), việc phân chia giai đoạn và điều trị của ung thư phổi tế bào nhỏ hoàn toàn khác với các loại ung thư phổi khác được gọi chung là ung thư phổi không phải tế bào nhỏ (NSCLC- non small cell lung cancer)

I/ DỊCH TỄ HỌC
Ung thư phổi phần lớn là bệnh của những người hút thuốc lá. 85% ung thư phổi xảy ra ở những người đã hoặc đang hút thuốc lá và 5% trường hợp được dự đoán xảy ra ung thư phổi như là hệ quả của sự phơi nhiễm thụ động với khói thuốc lá. Hút thuốc lá gây tăng tỷ lệ mắc bệnh của tất cả 4 loại mô học của ung thư phổi, mặc dù ung thư biểu mô tuyến (đặc biệt là sự biến đổi phế quản phế nang) cũng thấy ở những người không hút thuốc lá. Những yếu tố nguy cơ khác của ung thư phổi bao gồm sự phơi nhiễm với asbestos và radon. Các yếu tố gia đình như tính đa dạng của các hệ thống enzyme gan biến thể thành chất sinh ung thư cũng đóng một vai trò trong sự định đoạt thiên hướng phát sinh ung thư của mỗi cá nhân.
II/ SINH HỌC PHÂN TỬ
Những biến đổi di truyền đã cho thấy có liên quan với những khối u phổi. Những biến đổi di truyền thường gặp nhất bao gồm sự hoạt hoá và bộc lộ quá mức của các gen sinh ung thư myc trong ung thư phổi tế bào nhỏ và ung thư phổi không phải tế bào nhỏ và của gen sinh ung thư K- ras trong ung thư phổi không phải tế bào nhỏ, đặc biệt là ung thư biểu mô tuyến. sự không hoạt động và sự thiếu hụt gen p53 và gen ức chế u nguyên bào võng mạc và gen ức chế u trên nhiếm sắc thể 3p (gen FIHT) đã được thấy trong 50% đến 90% bệnh nhân ung thư phổi tế bào nhỏ. Những bất thường của p53 và 3p đã cho thấy có liên quan với 50% đến 70% trường hợp của ung thư phổi không phải tế bào nhỏ. Đột biến gen K- ras thường gặp hơn ở những ngưòi hút thuốc lá, với ung thư biểu mô tuyến và các khối u kém biệt hoá. điều này thì cũng liên quan với tiên lượng xấu.
Gần đây, những bất thường của yếu tố phát triển biểu bì (EGF- epidermal growth factor) đã được nhận thấy, điều này đã đưa đến liệu pháp điều trị đích chống ung thư. Thụ thể yếu tố phát triển biểu bì (EGFR- epidermal growth factor receptor) thì thường bộc lộ hoặc bộc lộ quá mức trong các khối u ung thư phổi không phải tế bào nhỏ. Việc gắn kết các phần tử kết hợp vào thụ thể yếu tố phát triển biểu bì sẽ gây nên một quá trình nhị trùng hóa các thụ thể, với khuynh hướng hoạt hoá tyrosine kinase trong tế bào của thụ thể. Sự phosphoryl hoá tự động của thụ thể gây ra những biến cố liên tiếp trong tế bào dẫn đến sự tăng sinh tế bào, ức chế sự chết của tế bào, sự sinh mạch và sự xâm lấn, hậu quả là sự phát triển và lan tràn của khối u. Sự ức chế thụ thể yếu tố phát triển biểu bì dẫn đến sự chết tế bào và sự thoái triển u trong các mô thức tiền lâm sàng. Vì lí do đó, thụ thể yếu tố phát triển biểu bì, các phần tử kết hợp và con đường truyền tín hiệu trở thành các đích cho liệu pháp điều trị chống ung thư. Các tác nhân điều trị đích bao gồm các yếu tố ức chế tyrosine kinase của thụ thể yếu tố phát triển biểu bì như gefitinib và erlotinib; các kháng thể đơn dòng cho thụ thể phát triển biểu bì, ngăn chặn sự phối hợp phần tử kết hợp với thụ thể phát triển biểu bì (ví dụ như cetuximab); và một số ít các nucleotide kháng cảm ức chế biểu hiện của thụ thể yếu tố phát triển biểu bì bởi quá trình thủy phân từng cặp theo thông điệp của các acid ribonucleic. Sự đột biến và bộc lộ quá mức của thụ thể đã được mô tả và có thể dự đoán đáp ứng với điều trị. Các yếu tố ức chế thụ thể yếu tố phát triển biểu bì, gefitinib và erlotinib đã được nghiên cứu nhiều nhất và được thảo luận trong các chủ đề tiếp theo sau.
III/ SỰ SÀNG LỌC
03 nghiên cứu sàng lọc ngẫu nhiên ở Mỹ trong những năm 1980 đã thất bại trong việc khám phá ra sự tác động đến tỷ lệ tử vong của việc sàng lọc ở những bệnh nhân có nguy cơ cao với chụp X- quang ngực và tế bào học đàm, mặc dù ung thư giai đoạn sớm đã được phát hiện trong các nhóm được sàng lọc. Tuy nhiên, kể từ đó, chụp cắt lớp vi tính xoắn ốc liều thấp đã nổi lên như là một công cụ mới có thể sử dụng được cho việc sàng lọc ung thư phổi. Chụp cắt lớp vi tính xoắn ốc có sự tạo ảnh chỉ với nhu mô phổi được quét, bàng cách đó sẽ phủ nhận việc sử dụng dịch tương phản tĩnh mạch và cần thiết cho sự tĩnh trí của thầy thuốc. Kiểu quét này thường có thể được thực hiện một cách nhanh chóng (chỉ trong một nhịp thở) và với liều thấp của bức xạ. Trong một nghiên cứu chứng không ngẫu nhiên của dự án tác động ung thư phổi sớm (early lung cancer action project), chụp cắt lớp vi tính liều thấp đã cho thấy độ nhạy cao hơn so với chụp x- quang ngực trong việc phát hiện các nốt phổi và ung thư phổi ở giai đoạn sớm. Mặc dù những kết quả này là đáng khich lệ, tuy nhiên điều này cũng không rõ có hay không việc sàng lọc với chụp cắt lớp vi tính xoắn ốc có kết quả trong việc giảm tỷ lệ tử vong do ung thư phổi. Những lo ngại bao gồm những vấn đề liên quan đến thiên hướng trong thời gian đầu, thiên hướng trong thời gian dài và chẩn đoán quá mức. Thêm nữa, ở một vài vùng địa lý như là miền trung tây nước Mỹ, tỷ lệ mắc các nốt lành tính cao quá mức làm cho chi phí của việc kiểm tra tiếp theo quá đắt. Để giúp giải quyết vấn đề này, gần đây viện ung thư quốc gia (Hoa Kỳ) đã hoàn tất một thử nghiệm chứng ngẫu nhiên lớn (nghiên cứu sàng lọc phổi) gồm xấp xỉ 50.000 người tham gia trên vài năm và các kết quả thì đang được chờ đợi.
IV/ UNG THƯ PHỔI KHÔNG PHẢI TẾ BÀO NHỎ
A/ Mô học.
Mặc dù những sự khác nhau về mô học (ung thư biểu mô tuyến đối với ung thư biểu mô tế bào lớn, ung thư biểu mô tế bào vảy) trong số các ung thư không phải tế bào nhỏ làm ảnh hưởng đến quá trình tự nhiên và biểu hiện bệnh, những sự khác biệt này liên quan ít quan trọng trong việc quyết định điều trị cho bệnh nhân, với hai khả năng có thể chấp nhận được. Một là, ung thư biểu mô phế quản phế nang, một bệnh biểu hiện với 2 hình thái (dạng nốt và lan toả) với khuynh hướng xảy ra ở những phụ nữ trẻ, những người chưa bao giờ hút thuốc, là một nhóm nhỏ bệnh nhân có nhiều khả năng nhận được lợi ích từ các tác nhân ức chế thụ thể yếu tố phát triển biểu bì. Hai là, các bệnh nhân ung thư biểu mô tế bào vảy có nhiều khả năng phát sinh khái huyết thì có bevacizumab, một kháng thể đơn dòng cho yếu tố phát triển nội mô mạch máu (VEGF- vascular endothelial growth factor).
B/ Sự phân chia giai đoạn.
Tiên lượng và điều trị của ung thư phổi không phải tế bào nhỏ phụ thuộc vào giai đoạn của bệnh tại thời điểm chẩn đoán. Những định nghĩa và hệ thống phân chia giai đoạn TNM gần đây được thấy ở bảng 7.1 và 7.2. Những điều cần lưu ý: nốt phổi trong cùng một thuỳ với u nguyên phát được đánh giá là T4, trong khi đó nếu ở khác thuỳ là M1; nếu tràn dịch màng phổi là dịch tiết hoặc dịch máu là T4 ngay cả nếu tế bào học dịch là âm tính. Những bệnh nhân ung thư phổi giai đoạn IIIB “ ướt” có tiên lượng giống với những bệnh nhân với tình trạng bệnh di căn, và vì vậy thường được gộp vào trong các thử nghiệm ung thư phổi không phải tế bào nhỏ tiến xa, trong khi những bệnh nhân giai đoạn IIIB “khô” thì thường được gộp vào các thử nghiệm tiến triển tại chỗ.
Bảng 7.1. Các định nghĩa TNM
U NGUYÊN PHÁT.
- Tx khối u đã được chứng minh bởi sự hiện diện của các tế bào ác tính trong chất tiết phế quản phế nang nhưng không nhìn thấy được trên phim X- quang hoặc nội soi phế quản hoặc khối u bất kỳ không thể đánh giá được, như là một sự đánh giá giai đoạn trước điều trị.
- To không có bằng chứng của khối u nguyên phát.
- Tis ung thư biểu mô tại chỗ.
- T1 khối u có kích thước lớn nhất ≤ 3 cm, được bao bọc xung quanh bởi phổi hoặc màng phổi tạng và không có bằng chứng xâm lấn đến phế quản thùy qua nội soi phế quản.
- T2 khối u có kích thước lớn nhất > 3 cm hoặc khối u với kích thước bất kỳ xâm lấn vào màng phổi tạng hoặc có liên quan với tình trạng xẹp phổi hoặc viêm phổi tắc nghẽn lan rộng đến vùng rốn phổi. Với nội soi phế quản, trong phạm vi gần có thể chứng minh được khối u phải nằm trong một phế quản thùy hoặc cách xa carina ít nhất là 2 cm . Bất kỳ một tình trạng xẹp phổi hoặc viêm phổi tăc nghẽn có liên quan nào cũng phải ít hơn toàn bộ một phổi.
- T3 khối u với kich thước bất kỳ có xâm lấn trực tiếp vào thành ngực ( bao gồm những khối u ở khe/ rãnh trên ), cơ hoành, hoặc màng phổi trung thất hoặc màng ngoài tim không bao gồm tim, các mạch máu lớn, khí quản, thực quản, thân đốt sống hoặc khối u cách carina 2cm nhưng không xâm lấn đến carina.
- T4 khối u với kích thước bất kỳ xâm lấn trung thất hoặc tim, các mạch máu lớn, khí quản, thực quản, thân đốt sống, hoặc carina hoặc tràn dịch màng phổi ác tính, nốt vệ tinh trong cùng thùy phổi.
HẠCH VÙNG
- N0 không có bằng chứng di can hạch vùng.
- N1 di căn hạch vùng quanh phế quản hoặc rốn phổi cùng bên hoặc cả hai, bao gồm sự xâm lấn trực tiếp.
- N2 di căn hạch trung thất cùng bên hoặc hạch dưới carina hoặc cả hai.
- N3 di căn hạch trung thất đối bên, hạch rốn phổi đối bên hoặc hạch cơ bậc thang, thượng đòn đối bên hay cùng bên.
DI CĂN XA.
- MX không đánh giá được di căn xa.
- M0 không có di căn xa.
- M1 di căn xa, bao gồm nốt phổi không cùng thùy với u nguyên phát.
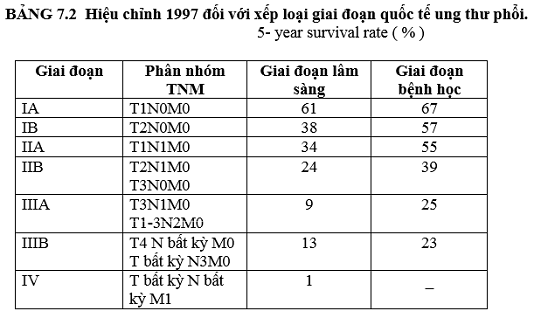
C. Đánh giá trước điều trị.
Chẩn đoán ung thư phổi thường được thực hiện bằng sinh thiết phế quản hoặc sinh thiết kim qua da. Mặc dù thường phát hiện bệnh bởi X- quang ngực, CT scan ngực là cần thiết để đánh giá mức độ tình trạng bệnh nguyên phát, sự xâm lấn trung thất hoặc tình trạng bệnh hạch bạch huyết, và sự hiện diện hoặc thiếu vắng những nốt tổn thương nhu mô khác ở những bệnh nhân được phẫu thuật cắt bỏ cần được cân nhắc. CT bụng trên được thực hiện để tìm kiếm những thương tổn di căn không triệu chứng ở gan và thượng thận (sau nữa là để phân biệt với u tuyến thượng thận lành tính). Chụp nhấp nháy xương nên được thực hiện ở những bệnh nhân có đau xương, đau ngực, hoặc đánh giá nồng độ calcium hoặc alkaline phosphatase. Chụp cắt lớp vi tính đầu hoặc cộng hưởng từ thì không thực hiện thường qui khi không có các dấu hiệu hoặc triệu chứng của hệ thần kinh trung ương (CNS central nervous system).
Di căn hạch trung thất là yếu tố có tính quyết định trong việc quyết định khả năng cắt bỏ u. Trong một thời gian dài, nội soi trung thất đã được xem là tiêu chuẩn vàng trong việc đánh giá giai đoạn trung thất và được đề nghị cho các hạch trung thất lớn hơn 1 cm trên CT Scan. Tuy nhiên gần đây, chụp phát xạ điện từ (PET positron emission tomography), một biến thể quét hình sử dụng F- 18- fluorodeoxyglucose, đã được phát triển như là một công cụ bổ sung hữu ích cho việc đánh giá giai đoạn. PET Scan thì thường nhạy và đặc hiệu hơn CT Scan và vì vậy có thể có khả năng dành cho những bệnh nhân có tình trạng bệnh tiến triển, bên trong hoặc bên ngoài ngực, xuất phát từ các phương thức xâm nhập cần thiết. Tuy nhiên điều này không rõ có hay không sự thay thế nội soi trung thất bởi PET Scan, vì PET scan có thể có kết quả dương tính giả trong các tình trạng viêm nhiễm và âm tính giả trong các khối u phổi có hoạt động chuyển hóa thấp như là ung thư biểu mô phế quản phế nang hoặc các khối u tế bào ưa bạc (carcinoid tumors).
Kiểm tra chức năng phổi là cần thiết trước khi quyết định phẫu thuật. Tình trạng hậu phẫu nặng lên có liên quan với thể tích hô hấp bắt buộc 1 giây ước đoán sau mổ ít hơn 800 đến 1000ml, thông khí tự động tối đa trước mổ ít hơn 35% ước đoán, dung tích khuếch tán carbon monoxide ít hơn 60% ước đoán và áp lực oxy động mạch (PO2) thấp hơn 60mmHg hoặc áp lực carbon dioxide (PCO2) cao hơn 45mmHg.
D. ĐIỀU TRỊ
1/ UNG THƯ PHỔI KHÔNG PHẢI TẾ BÀO NHỎ GIAI ĐOẠN SỚM
A/ GIAI ĐOẠN I
Phẫu thuật cắt thùy phổi là phương pháp điều trị chính cho ung thư phổi không phải tế bào nhỏ giai đoạn I, với tỷ lệ điều trị triệt căn từ 60 đến 80%. Ở những bệnh nhân có chống chỉ định phẫu thuật nhưng chức năng phổi thỏa đáng, xạ trị liều cao cho kết quả điều trị triệt căn xấp xỉ 20% bệnh nhân. Những bệnh nhân với tình trạng bệnh ở giai đoạn IB (T2N0) thì không tốt như các ung thư giai đoạn IA (T1N0). Hóa trị bổ trợ sau mổ cần được quan tâm vì một phân tích tổng hợp năm 1995 đã cho thấy đường thống kê sống thêm có ý nghĩa của phẫu thuật và hóa trị lợi ích hơn khi so với phẫu thuật đơn độc (p= 0,07). Những thử nghiệm lâm sàng ngẫu nhiên gần đây sử dụng hóa trị bổ trợ kép nền tảng là platinum đã chứng thực lợi ích sống thêm có ý nghĩa đối với những bệnh nhân ở giai đoạn sớm (bảng 7.3). Một thử nghiệm ung thư và bạch cầu cấp nhóm B (CALGB – cancer and leukemia group B 9633) với những bệnh nhân ung thư phổi không phải tế bào nhỏ giai đoạn IB đã được phẫu thuật, một số bệnh nhân được nhận ngẫu nhiên 4 chu kỳ hóa trị bổ trợ Carboplatin kết hợp với Paclitaxel hoặc chỉ quan sát. Trong một báo cáo sơ bộ phân tích tạm thời, hóa trị bổ trợ có liên quan với sự cải thiện có ý nghĩa sống thêm toàn bộ 4 năm(71% đối với 59%). Một thử nghiệm được công bố gần đây của viện ung thư quốc gia Canada (NCIC- national cancer institute of Canada- JBR.10) với những bệnh nhân ung thư phổi không phải tế bào nhỏ giai đoạn IB và II (ngoại trừ T3N0) được chỉ định ngẫu nhiên phẫu thuật đơn độc hoặc tiếp sau phẫu thuật là 4 chu kỳ Cisplatin và Vinorebine đã được báo cáo sự cải thiện tuyệt đối 15% về thời gian sống thêm toàn bộ 5 năm (69% đối với 54%). Ở những bệnh nhân với tình trạng bệnh ở giai đoạn IB đến IIIA, thiên về nhánh hóa trị.
Bằng chứng hóa trị bổ trợ cho những bệnh nhân giai đoạn IA đã được phẫu thuật cắt bỏ ít rõ ràng hơn. Một thử nghiệm của người Nhật với những bệnh nhân ung thư phổi không phải tế bào nhỏ giai đoạn I (73% giai đoạn IA, 27% giai đoạn IB), một số bệnh nhân được uống ngẫu nhiên dẫn xuất 5- fluorouracil (Tegafur cộng với Uracil, UFT) so với phẫu thuật đơn độc. Các kết quả đã cho thấy là khiêm tốn nhưng có cải thiện có ý nghĩa thời gian sống thêm 5 năm ở nhóm dùng UFT (88% so với 85%). Tuy nhiên, trong phân tích phân nhóm, sự cải thiện thời gian sống thêm 5 năm đã dược quan sát thấy ở những bệnh nhân giai đoạn IB (sống thêm 5 năm là 85% so với 74%), không có sự khác biệt ở giai đoạn IA (sống thêm 5 năm là 89% so với 90 %). Hiện nay UFT không sẵn có ở Bắc Mỹ. Xác định dữ liệu này, thật hợp lý để đưa ra đề nghị hóa trị kép bổ trợ với nền tảng platinum cho những bệnh nhân giai đoạn IB đã được phẫu thuật cắt bỏ và có tình trạng hoạt động thể lực tốt cho đến khi các kết quả xác thực hơn được báo cáo. Những nghiên cứu thêm nữa là cần thiết cho tình trạng bệnh ở giai đoạn IA trước khi đưa ra đề nghị điều trị bổ trợ thường qui cho nhóm bệnh nhân này.
Những bệnh nhân ung thư phổi không phải tế bào nhỏ giai đoạn I đã được phẫu thuật cắt bỏ có nguy cơ cao phát sinh ung thư phổi thứ hai (khoảng từ 2-3% mỗi năm).Vitamin A hoặc dẫn xuất của nó, β- carotene hoặc acid cis- retinoic đã cho thấy có nhiều lợi ích trong hóa dự phòng trái ngược với dự đoán là có thể có hại. Các tác nhân khác như selen (selenium) còn đang nghiên cứu.
B/ GIAI ĐOẠN II.
Phẫu thuật cắt bỏ là phương thức điều trị chuẩn cho ung thư phổi không phải tế bào nhỏ giai đoạn II. Phân nhóm T3N0 có quá trình tiến triển tự nhiên và chiến lược điều trị khác với tình trạng bệnh giai đoạn III có hạch N2 và vì vậy nó được dịch chuyển lên giai đoạn II. Những bệnh nhân với tình trạng bệnh xâm lấn thành ngực nên được phẫu thuật cắt bỏ các xương sườn và phần phổi liên quan. Phần thành ngực khiếm khuyết sau đó được sữa chữa bằng hệ cơ thành ngực hoặc mạng lưới Marlex và Methylmethacrylate. Xạ trị hậu phẫu thường được bổ sung. Tỷ lệ sống thêm 5 năm cao 50% đã được báo cáo.
Những thử nghiệm ngẫu nhiên gần đây đã chứng thực vai trò của hóa trị bổ trợ sau phẫu thuật cắt bỏ cho những bệnh nhân ung thư phổi không phải tế bào nhỏ giai đoạn II (bảng 7.3). Một trong những thử nghiệm khẳng định đầu tiên đã được công bố năm 2004 bởi nhóm cộng tác thử nghiệm bổ trợ ung thư phổi quốc tế (international adjuvant lung cancer trial collaborative group) với những bệnh nhân ung thư phổi không phải tế bào nhỏ đã được phẫu thuật cắt bỏ được chỉ định ngẫu nhiên (giai đoạn bệnh học là giai đoạn I đến IIIA) hoặc phẫu thuật đơn độc hoặc phẫu thuật cộng với 3-4 chu kỳ hóa trị kép có Cisplatin. Việc chọn lựa hóa trị kép (Cisplatin cộng với hoặc là Etoposide, hoặc Vinblastine, hoặc Vinorelbine hoặc Vindesine) và việc sử dụng xạ trị bổ trợ thành ngực được quyết định liều tùy theo tình trạng của từng bệnh nhân.Nghiên cứu đã chứng thực sự cải thiện thời gian sống thêm 5 năm là 5% (45% so với 40%) thiên về nhóm hóa trị. Những kết quả thử nghiệm của hiệp hội thử nghiệm bổ trợ Navelbine quốc tế (adjuvant navelbine international trialist association- ANITA) đã ủng hộ thêm nữa cho hóa trị bổ trợ. Trong nghiên cứu này, những bệnh nhân ung thư phổi không phải tế bào nhỏ giai đoạn IB đến IIIA được ngẫu nhiên phẫu thuật đơn độc so với phẫu thuật cộng với hóa trị Cisplatin và Vinorelbine 4 chu kỳ. Trong một báo cáo sơ bộ, thời gian sống thêm toàn bộ 5 năm đã cải thiện có ý nghĩa (51% so với 43%), mặc dầu lợi ích sống thêm bị hạn chế ở những bệnh nhân với tình trạng bệnh giai đoạn II và IIIA. Những dữ liệu kết hợp với những kết quả của các thử nghiệm NCIC đã được báo cáo chi tiết trong đề mục trước đã đưa đến một khuyến nghị rằng những bệnh nhân ung thư phổi không phải tế bào nhỏ có giai đoạn bệnh học IB, II và IIIA sau khi được phẫu thuật cắt bỏ nên được hóa trị bổ trợ với nền tảng Platinum.
2/ TIẾN TRIỂN TẠI CHỖ ( giai đoạn IIIA và IIIB )
Điều trị ung thư phổi không phải tế bào nhỏ tiến triển tại chỗ là một trong những vấn đề tranh luận nhiều nhất trong điều trị ung thư phổi.Việc làm sáng tỏ những kết quả của các thử nghiệm lâm sàng bao gồm những bệnh nhân có tình trạng bệnh tiến triển tại chỗ bị che mờ bởi một số vấn đề bao gồm sự thay đổi các kỹ thuật chẩn đoán, sự khác nhau về các hệ thống phân chia giai đoạn bệnh, các nhóm bệnh nhân không đồng nhất với tình trạng bệnh được xếp loại từ không lan rộng giai đoạn IIIA (hạch N1 dựa theo lâm sàng, hạch N2 chỉ phát hiện qua nội soi tại thời điểm phẫu thuật hoặc soi trung thất) đến lan rộng với hạch N2 (tình trạng bệnh lý hạch lan rộng nhìn thấy được trên X- quang ngực hoặc lan tràn nhiều hạch) đến tình trạng bệnh không thể phẫu thuật được giai đoạn IIIB.
a/ Giai đoạn IIIA không lan rộng.
Việc chọn lựa điều trị cho tình trạng bệnh ở giai đoạn IIIA còn đang tranh luận. Những nỗ lực nghiên cứu gần đây đã hoàn toàn xác nhận việc chọn lựa điều trị đa mô thức, bao gồm việc điều trị triệt để với kiểm soát tại chỗ (phẫu thuật hoặc xạ trị) và vi di căn ( hóa trị ).Có thể có nhiều khả năng bao gồm phẫu thuật tiếp theo sau là hóa trị bổ trợ, hóa trị trước mổ cộng với phẫu thuật, hoặc hóa trị cộng với xạ trị.
Điều trị chủ yếu cho giai đoạn II và giai đoạn IIIA sớm (lâm sàng hạch N0 và N1) là phẫu thuật cắt bỏ. Tuy nhiên ngay cả khi phẫu thuật cắt bỏ hoàn toàn thì tỷ lệ điều trị triệt căn cũng làm thất vọng, thúc đẩy việc nghiên cứu hóa trị và xạ trị bổ trợ. Xạ trị hậu phẫu đã cho thấy giảm sự tái phát tại chỗ sau phẫu thuật cắt bỏ đối với ung thư phổi biểu mô vảy giai đoạn II và III nhưng không kéo dài thời gian sống thêm. Những thử nghiệm ngẫu nhiên với hóa trị kép bổ trợ dựa trên nền tảng Cisplatin đã chứng thực lợi ích sống thêm toàn bộ 5 năm từ 5% đến 15% và điều này được đề nghị thực hiện thường qui cho những bệnh nhân ung thư phổi không phải tế bào nhỏ giai đoạn II hoặc IIIA đã được phẫu thuật cắt bỏ có tình trạng hoạt động thể lực tốt.
Mặc dầu những bệnh nhân có tình trạng hạch N2 cũng thường được điều trị kết hợp hóa xạ trị, đã có nhiều nghiên cứu cho thấy vai trò của phẫu thuật trong tình trạng bệnh này. Hai nghiên cứu ngẫu nhiên nhỏ xác thực điều này gồm hơn 40 bệnh nhân, so sánh nhóm bệnh nhân phẫu thuật có hoặc không hóa trị trước mổ. Trong một nghiên cứu ở Châu Âu, hóa trị trước mổ (Mitomycin, Ifosfamide và Cisplatin với 3 chu kỳ) tiếp theo sau là phẫu thuật đã được so sánh với phẫu thuật không có hóa trị trước mổ ở những bệnh nhân với bệnh ở giai đoạn III. Tất cả bệnh nhân cũng đều được xạ trị vào trung thất sau phẫu thuật. Thời gian sống thêm trung bình là 26 tháng ở 30 bệnh nhân nhận hóa trị trước mổ cộng với phẫu thuật so với 8 tháng ở 30 bệnh nhân chỉ được phẫu thuật đơn độc.
Các nghiên cứu tại trung tâm ung thư Aderson, bệnh nhân được chọn ngẫu nhiên để phẫu thuật hoặc hóa trị 3 chu kỳ Cyclophosphamide, Etoposide và Cisplatin sau đó phẫu thuật và hóa trị 3 chu kỳ sau phẫu thuật. Thời gian sống thêm trung bình của 32 bệnh nhân trong nhóm phẫu thuật đơn độc là 14 tháng so với 21 tháng ở nhánh điều trị đa mô thức.
Trong một thử nghiệm ngẫu nhiên lớn hơn, các nghiên cứu ở Pháp so sánh hóa trị tiền phẫu Mitomycin, Ifosfamide và Cisplatin cộng với phẫu thuật với phẫu thuật đơn độc trên 355 bệnh nhân có thể cắt bỏ được ở giai đoạn I (ngoại trừ T1,N0), giai đoạn II và giai đoạn III (bao gồm tình trạng hạch N2). Sự khác biệt về thời gian sống thêm trung bình giữa 2 nhánh không có ý nghĩa thống kê (37 tháng so với 26 tháng; p= 0,15). Tuy nhiên phân tích phân nhóm gợi ý rằng có sự cải thiện về thời gian sống thêm ở hóa trị tân bổ trợ cho N0 đến N1 nhưng không cải thiện đối với N2.
Điều trị 3 phương thức cũng đã được nghiên cứu trong một thử nghiệm ngẫu nhiên giữa các nhóm, ở đó các bệnh nhân ung thư giai đoạn IIIA tiến triển nhận liều xạ trị qui nạp 45Gy cộng với 2 chu kỳ hóa trị Cisplatin và Etoposide, tiếp theo được chỉ định ngẫu nhiên để phẫu thuật hoặc xạ trị tăng cường cộng thêm với 2 chu kỳ hóa trị. Trong một phân tích tạm thời lần hai, có sự cải thiện có ý nghĩa về thời gian sống thêm không bệnh 5 năm ở nhóm 3 phương thức (22% so với 11%; p= 0,017) và mặc dầu cũng có khuynh hướng tốt hơn về thời gian sống thêm toàn bộ 5 năm ở nhóm điều trị 3 phương thức, điều này thì không có ý nghĩa (27% so với 20%; p= 0,10). Có nhiều trường hợp tử vong liên quan đến điều trị trong nhánh phẫu thuật hơn so với nhánh hóa xạ trị đơn độc (8% so với 2%), với số trường hợp tử vong nhiều nhất xảy ra ở những bệnh nhân trải qua phẫu thuật cắt phổi. Vai trò của điều trị 3 phương thức cho ung thư phổi không phải tế bào nhỏ giai đoạn IIIA vẫn còn tranh luận bởi tình trạng bệnh nặng lên và tỷ lệ tử vong liên quan đến điều trị, đặc biệt là ở những bệnh nhân cần phải cắt phổi bên phải.
Một vài nghiên cứu đã cho thấy rằng, trong phân tích phân nhóm, mà ở đó những bệnh nhân nhận điều nhận điều trị tân bổ trợ sau đó hạch N2 được làm sạch với điều trị trước mổ thì tốt hơn là những người không điều trị tân bổ trợ. Điều này thúc đẩy nhiều nghiên cứu cho điều trị trước mổ và sau đó lấy mẫu hạch N2. Nếu dương tính thì đóng ngực và bệnh nhân sẽ nhận hóa xạ trị triệt căn. Tuy nhiên, nếu hạch hướng về âm tính thì bệnh nhân sẽ được phẫu thuật triệt căn. Cần lưu ý rằng, những bệnh nhân đã được cắt phổi phải sau xạ trị có tỷ lệ tử vong trên 20% trong vài nhóm.
Khi viết điều này, không có bằng chứng cấp 1 để tiến cử hóa trị tân bổ trợ lên trên hóa trị bổ trợ mặc dù có nhiều lí do về mặc lý thuyết cũng như thực tế là bệnh nhân có nhiều khả năng dung nạp hóa trị trước mổ hơn là hóa trị sau mổ. Các kết quả từ các nghiên cứu ngẫu nhiên thì được chờ đợi.
b/ Các khối u Pancoast.
Các khối u Pancooast là những khối u ở thùy trên tiếp giáp với đám rối cánh tay và thường liên quan với hội chứng Horner hoặc đau vai và đau cánh tay; sau cùng gây ra sự phá hủy xương sườn, xâm lấn rễ thần kinh C8 hoặc T1, hoặc cả hai. Việc điều trị bao gồm sự kết hợp đa mô thức với xạ trị và phẫu thuật. Tỷ lệ sống thêm 5 năm thay đổi từ 25% đến 50%. Việc kết hợp hóa xạ trị trước mổ và xạ trị đang được nghiên cứu.
c/ Giai đoạn IIIA lan rộng (N2 ) và giai đoạn IIIB không có tràn dịch màng phổi.
Giai đoạn IIIA lan rộng và IIIB thường được xem là không thể phẫu thuật, việc điều trị bao gồm hóa xạ trị kết hợp hoặc trong trường hợp giai đoạn IIIB có tràn dịch màng phổi ác tính thì hóa trị đơn độc.
Hóa trị cộng với xạ trị.
Hóa trị cộng với xạ trị là phương thức điều trị được lựa chọn cho những bệnh nhân giai đoạn IIIA lan rộng hoặc không thể phẫu thuật được hoặc giai đoạn IIIB không có tràn dịch màng phổi. Nhiều nghiên cứu ngẫu nhiên đã chứng thực sự cải thiện thời gian sống thêm trung bình và kéo dài thời gian sống với hóa trị cộng với xạ trị so với xạ trị đơn độc. Các lĩnh vực được nghiên cứu tích cực bao gồm xạ trị vào vùng ngực liên tục riêng rẽ và hóa trị (đồng thời đối với nối tiếp), lựa chọn hóa trị, phân liều và các trường chiếu.
Một thử nghiệm ngẫu nhiên của người Nhật đã báo cáo sự cải thiện về thời gian sống thêm 3 tháng với hóa xạ đồng thời hơn là điều trị liên tiếp. Các báo cáo từ thử nghiệm ngẫu nhiên của nhóm xạ trị ung thư cũng đã cho thấy khuynh hướng thiên về hóa trị Cisplatin và Vinblastin đồng thời với xạ trị hơn là hóa xạ trị liên tiếp, mặc dù có nhiều độc tính hơn, việc điều trị hóa xạ đồng thời được thực hiện với sự chọn lựa bệnh nhân có tình trạng hoạt động tốt.
Hóa trị có thể được cho liều “ toàn thân” đầy đủ cùng với xạ trị, xạ trị với liều “ xạ nhạy” mỗi tuần hoặc kết hợp cả hai. Một trong các phác đồ hóa trị thường được được sử dụng nhất cho ung thư phổi không phải tế bào nhỏ giai đoạn III là Carboplatin kết hợp với Paclitaxel (bảng 7.4). Măc dầu Carboplatin đơn độc mỗi tuần không đem lại kết quả về lợi ích sống thêm khi được cho cùng lúc với xạ trị, liều Paclitaxel 50mg/m2 và Carboplatin AUC 2 mỗi tuần đồng thời với xạ trị đã chứng minh triển vọng của các nghiên cứu ngẫu nhiên pha 2.
Các lĩnh vực nghiên cứu khác bao gồm vai trò liều toàn thân chuẩn của hóa trị hoặc trước hoặc sau hóa xạ trị đồng thời với liều xạ nhạy mỗi tuần. Trong một thử nghiệm pha III, CALGB đã không cho thấy lợi ích sống thêm khi hóa trị qui nạp được cho trước hóa xạ trị liều thấp mỗi tuần so với hóa xạ trị liều thấp mỗi tuần đơn độc. Tuy nhiên, một thử nghiệm ngẫu nhiên pha II của nhóm ung thư Tây
BẢNG 7.4. Các phác đồ hóa trị trong hóa xạ trị đồng thời cho ung thư phổi không phải tế bào nhỏ giai đoạn III

3/ GIAI ĐOẠN IV
Hóa trị cải thiện thời gian sống thêm cho các bệnh nhân ung thư phổi không phải tế bào nhỏ di căn (tỷ lệ sống thêm 1 năm khoảng 10% đối với những bệnh nhân không điều trị so với 30% đến 35% đối với những bệnh nhân có điều trị . Các mục tiêu điều trị bao gồm giảm nhẹ triệu chứng và cải thiện khiêm tốn thời gian sống thêm.
Các yếu tố chính dự đoán sự đáp ứng với hóa trị và thời gian sống thêm là tình trạng hoạt động và phạm vi (qui mô) của bệnh. Những bệnh nhân với tình trạng hoạt động kém (tình trạng hoạt động theo nhóm hợp tác ung thư Đông Âu – ECOG - eastern cooperative oncology group- từ 2 đến 4) thì ít có khả năng đáp ứng và dung nạp kém với điều trị, mặc dầu các phân tích phân nhóm hồi cứu gần đây đã gợi ý rằng những bệnh nhân với tình trạng hoạt động mức 2 theo ECOG cũng có thể hưởng lợi ích khiêm tốn về thời gian sống thêm với điều trị. Các yếu tố tiên lượng có ích bao gồm không sút cân, giới nữ, nồng độ Lactate dehydrogenase trong huyết thanh bình thường và không có di căn xương hoặc di căn gan.
a/ Hóa trị bước một.
Hóa trị cho những bệnh nhân ung thư phổi không phải tế bào nhỏ di căn và tình trạng hoạt động tốt nên thực hiện phác đồ hóa trị gồm 2 thuốc. Một phân tích tổng hợp từ các thử nghiệm ngẫu nhiên lớn đã cho thấy rằng có sự cải thiện về thời gian sống thêm khi hóa trị với nền tảng Platinum so với chăm sóc nâng đỡ. Trong khi kết quả của việc chăm sóc nâng đỡ tốt nhất với tỷ lệ sống thêm trung bình từ 4 đến 5 tháng và tỷ lệ sống thêm 1 năm từ 5% đến 10%, gần đây các phác đồ có thuốc thế hệ 3 với Paclitaxel và Docetaxel, Gemcitabine, Vinorelbine, và Irinotecan đã mang lại thời gian sống thêm trung bình từ 8 đến 9 tháng và sống thêm 1 năm là 35% đến 40%. Thêm nữa, các nghiên cứu ngẫu nhiên đã cho thấy sự cải thiện triệu chứng và chất lượng cuộc sống so với những bệnh nhân được điều trị chăm sóc nâng đỡ.
b/ Chọn lựa hóa trị
Nhiều nghiên cứu ngẫu nhiên đã thất bại để cho thấy sự cải thiện lớn của một phác đồ hóa trị kép mới hơn là những phác đồ khác. Các phác đồ hóa trị chung cho ung thư phổi không phải tế bào nhỏ được thấy trong bảng 7.5.
Mặc dầu một sự chỉ dẫn so sánh giữa hóa trị nền Cisplatin và Carboplatin là có giới hạn, phân tích tổng hợp đã gợi ý rằng Cisplatin có lợi ích nhỏ trong việc kéo dài thời gian sống thêm hơn là Carboplatin, mặc dầu có sự khác nhau về nét đặc trưng độc tính. Trong khi sự khác biệt nhỏ này có thể bị giới hạn về hiệu quả lâm sàng cho những bệnh nhân có tình trạng bệnh di căn, nó có lẽ quan trọng hơn trong việc xác lập điều trị bổ trợ, ở đó việc điều trị triệt căn là mục tiêu.
BẢNG 7.5. Các phác đồ hóa trị chung cho ung thư phổi không phải tế bào nhỏ di căn.

AUC, phạm vi dưới đường cong.
a Những bệnh nhân có di căn não, mô học tế bào vảy, dùng thuốc chống đông không được nhận Bevacizumab từ nghiên cứu lâm sàng.
c/ Các chất ức chế sinh mạch
Chất ức chế sinh mạch dựa trên việc quan sát sự tạo mạch mới ở mô u và hiếm khi có trong quá trình sinh lý khác ngoại trừ sự lành vết thương. Việc phát triển lý thuyết cho sự sinh mạch đích bao gồm cơ sở lập luận rằng các tế bào nội mô là lưỡng bội, không đột biến và vì vậy ít có khả năng phát sinh sự kháng thuốc. Yếu tố phát triển nội mạch (VEGF- vascular endothelial growth factor) là chất kích thích có hiệu quả sự hình thành các mạch máu mới. Thông qua sự gắn kết vào các thụ thể của chúng (thụ thể yếu tố phát triển nội mạch – VEGFR- vascular endothelial growth factor receptor) trên các tế bào nội mô. VEFG khởi phát các con đường sinh học dẫn đến các sự kiện khác nhau bao gồm sự sinh sôi tế bào nội mô và sự di trú, sắp xếp lại mạng lưới ngoài tế bào và sự tạo mạch u. Mặc dầu có nhiều tác nhân chống tăng sinh mạch đang được nghiên cứu, chẵn hạn như chất ức chế Tyrosine kinase của thụ thể yếu tố phát triển nội mạch, thuốc Bevacizumab (Avastin) một kháng thể đơn dòng kháng VEGF (yếu tố phát triển nội mạch) đã cho thấy lợi ích sống thêm trong ung thư phổi không phải tế bào nhỏ.
Bevacizumab đã được đánh giá trong một thử nghiệm ngẫu nhiên ECOG kết hợp với hóa trị độc tế bào chuẩn cho ung thư phổi không phải tế bào nhỏ tiến triển. Trong một báo cáo của thử nghiệm này gần đây, 878 bệnh nhân ung thư phổi không phải tế bào nhỏ tiến triển đã được nhận ngẫu nhiên Carboplatin và Paclitaxel có hay không có Bevacizumab (15mg/kg) mỗi 3 tuần cho 6 chu kỳ. Bevacizumab được tiếp tục cho trên 1 năm ở những bệnh nhân với tình trạng bệnh không tiến triển. Những bệnh nhân có mô học là tế bào vảy, di căn não, tiền sử xuất huyết hoặc rối loạn chảy máu và những bệnh nhân đang sử dụng thuốc chống đông dược loại trừ ra khỏi dữ liệu pha II vì đã cho thấy những biến cố xuất huyết như là một biến chứng khi điều trị với Bevacizumab. Nghiên cứu đã chứng minh sự cải thiện về thời gian sống thêm trung bình (12,5 tháng so với 10,2 tháng; p= 0,007), tỷ lệ đáp ứng toàn bộ (27,2% so với 10%) và thời gian sống thêm không bệnh (6,4 tháng so với 4,5 tháng), thiên về nhánh Bevacizumab.
d/ Thời gian điều trị.
4 nghiên cứu ngẫu nhiên đã thất bại để chỉ ra một sự khác nhau về thời gian sống thêm bằng việc kéo dài các chu kỳ hóa trị (nhiều hơn 6 chu kỳ) so với các chu kỳ hóa trị ít hơn (4 đối với 6 chu kỳ). Vì vậy việc hóa trị liên tục cho đến khi bệnh tiến triển thường không được tiến cử.
e/ Hóa trị kép so với hóa trị bộ ba.
Nhiều thử nghiệm ngẫu nhiên đã thất bại để chứng thực sự cải thiện thời gian sống thêm của việc hóa trị 3 thuốc tốt hơn so với 2 thuốc, và đã có sự trả giá cho sự tăng cường độc tính. Vì vậy, các phác đồ gồm 3 thuốc không thường được tiến cử ngoài một thử nghiệm lâm sàng.
f/ Các phác đồ không có Platin.
Xem xét các độ tính có liên quan với Cisplatin, có sự quan tâm cân nhắc trong việc kết hợp 2 thuốc không phải Platin. Hầu hết các thử nghiệm ngẫu nhiên gần đây đã thất bại để chỉ ra sự khác biệt có ý nghĩa về thời gian sống thêm với phác đồ có Platin so với các phác đồ không có Platin mặc dầu đặc trưng về độc tính là khác nhau.
g/ Di căn não riêng biệt.
Ở những bệnh nhân có tình trạng bệnh đã được kiểm soát ngoài não mà có di căn não ở những vùng có thể phẫu thuật được, việc phẫu thuật cắt bỏ sau đó xạ trị toàn não thì tốt hơn là xạ trị toàn não đơn độc.
4/ HÓA TRỊ BƯỚC 2.
Docetaxel, Pemetrexed và Erlotinib gần đây đã được chấp thuận bởi cơ quan quản lý thuốc và thực phẩm hoa kỳ (U.S food and drug administration- FDA) cho hóa trị đơn độc ở những bệnh nhân ung thư phổi không phải tế bào nhỏ di căn.
a/ Docetaxel.
Đã có 2 thử nghiệm ngẫu nhiên đánh giá hóa trị Docetaxel bước 2 so với chăm sóc nâng đỡ ở những bệnh nhân đã thất bại với điều trị bước 1. Docetaxel với liều 75mg/m2 mỗi 3 tuần kéo dài thời gian sống thêm có ý nghĩa so với chăm sóc nâng đỡ và khi so sánh hoặc với Vinorelbine hoặc với Ifosfamide có sự cải thiện thời gian sống thêm không bệnh và sống thêm 1 năm. Hơn nữa, nó cũng cải thiện chất lượng cuộc sống. Một điều cần lưu ý là ở những bệnh nhân đã được điều trị với Paclitaxel trước đó thì không ảnh hưởng đến sự đáp ứng của bệnh nhân với Docetaxel, điều này gợi ý rằng không có sự kháng thuốc chéo giữa 2 tác nhân Taxane.
b/ Pemetrexed.
Pemetrexed, một chất kháng folate nhiều đích, có hoạt tính kháng u giống như Docetaxel trong việc thiết lập điều trị bước 2, có ít độc tính hơn. Trong một thử nghiệm ngẫu nhiên, những bệnh nhân đã được điều trị với Pemetrexed 500mg/m2 hoặc Docetaxel 75mg/m2 mỗi 3 tuần và tỷ lệ đáp ứng toàn bộ là tương đương ( 9,1% so với 8,8% cho Pemetrexed và Docetaxel, lần lượt theo thứ tự ). Docetaxel có liên quan với tỷ lệ cao hơn giảm bạch cầu, sốt do giảm bạch cầu và việc nhập viện do các biến cố của giảm bạch cầu hoặc các biến cố trầm trọng khác có liên quan đến thuốc khi so sánh với Pemetrexed.
c/ Các chất ức chế thụ thể yếu tố phát triển biểu mô (EGFR- epithelial growth factor receptor).
(1) Gefitinib.
Điều trị đơn độc với Gefitinib đã được nghiên cứu trong 2 thử nghiệm đa trung tâm pha II: một nghiên cứu được thực hiện ở Mỹ và các nghiên cứu khác được thực hiện chủ yếu ở Nhật Bản và Châu Âu. Cả hai nghiên cứu bao gồm những bệnh nhân ung thư phổi không phải tế bào nhỏ tiến triển đã thất bại với phác đồ hóa trị
(2) Erlotinib.
Erlotinib giống như chất ức chế Tyrosine kinase của thụ thể yếu tố phát triển biểu mô sẵn có bằng đường uống. Điều trị đơn độc với Erlotinib trong việc thiết lập điều trị bước 2 và bước 3 cho những bệnh nhân ung thư phổi không phải tế bào nhỏ di căn đã được đánh giá trong một công bố thử nghiệm ngẫu nhiên gần đây, BR21, ở
V/ UNG THƯ BIỂU MÔ TẾ BÀO NHỎ.
Ung thư phổi tế bào nhỏ (SCLC- small cell lung cancer) khác với ung thư phổi không phải tế bào nhỏ (NSCLC- non small cell lung cancer) về một số phương diện quan trọng. Thứ nhất, nó có quá trình phát triển tự nhiên và thời gian lâm sàng nhanh hơn, với việc phát sinh nhanh sự di căn, các triệu chứng và tử vong. Nếu không điều trị, thời gian sống thêm trung bình cho các bệnh nhân có tình trạng bệnh tại chỗ là 12 tuần đến 15 tuần và thời gian sống thêm trung bình cho các bệnh nhân có tình trạng bệnh tiến triển là 6 đến 9 tuần. Thứ hai, nó biểu lộ nhiều nét đặc trưng về sự khác biệt thần kinh nội tiết ở nhiều bệnh nhân (mà có thể phân biệt được bằng mô bệnh học) và có liên quan với các hội chứng cận u. Thứ ba, không giống như ung thư phổi không phải tế bào nhỏ, ung thư phổi tế bào nhỏ rất nhạy với hóa trị và xạ trị mặc dầu bệnh thường phát sinh tình trạng kháng thuốc. Bởi sự phát sinh nhanh tình trạng di căn xa và sự nhạy cảm quá mức của nó với các tác nhân hóa trị độc tế bào, phương thức điều trị này là hình thái điều trị chính yếu, bất kể giai đoạn bệnh.
A/ PHÂN CHIA GIAI ĐOẠN.
Mặc dầu ung thư phổi tế bào nhỏ có khuynh hướng di căn nhanh và tình trạng vi di căn thì được cho là hiện diện ở tất cả các bệnh nhân tại thời điểm chẩn đoán, bệnh này thường được phân loại thành hoặc là giai đoạn khu trú tại chỗ, hoặc là giai đoạn lan tràn. Tình trạng bệnh tại chỗ được định nghĩa như là một tình trạng bệnh có thể được vây quanh trong một trường chiếu xạ, thường được xem là giới hạn đến nữa ngực và các hạch vùng, bao gồm trung thất và các hạch thượng đòn cùng bên. Giai đoạn bệnh lan tràn thường được định nghĩa như là tình trạng bệnh lan tràn ra ngoài các khu vực này.
B/ ĐÁNH GIÁ TRƯỚC ĐIỀU TRỊ.
Các vị trị trí thường hay di căn của ung thư phổi tế bào nhỏ bao gồm não, gan, tủy xương, xương và hệ thần kinh trung ương. Vì lí do này, việc thực hiện đánh giá giai đoạn toàn diện theo truyền thống bao gồm đếm tế bào máu toàn bộ; kiểm tra chức năng gan; chụp cắt lớp vi tính não, ngực và bụng; chụp nhấp nháy xương; chọc hút và sinh thiết tủy xương. Tuy nhiên, việc thực hiện đánh giá giai đoạn bệnh toàn diện không nhất thiết phải thực hiện trừ khi bệnh nhân là ứng cử viên cho việc điều trị kết hợp đa mô thức với xạ trị vào ngực và hóa trị, những bệnh nhân đang được đánh giá cho một nghiên cứu lâm sàng hoặc thông tin là hữu ích với các lí do để tiên lượng. Nếu bệnh nhân không phải là ứng cử viên cho việc điều trị đa mô thức hoặc cho một nghiên cứu lâm sàng, dừng việc đánh giá giai đoạn ở bằng chứng đầu tiên cho tình trạng bệnh ở giai đoạn lan tràn thông thường là thích hợp. Việc di căn tủy xương riêng biệt thường được cho là hiếm khi xảy ra, sinh thiết và chọc hút tủy xương thường không được thực hiện.
C/ CÁC YẾU TỐ TIÊN LƯỢNG.
Cũng như ung thư phổi không phải tế bào nhỏ, các yếu tố tiên lượng chính trước điều trị là giai đoạn bệnh, tình trạng hoạt động và độ lan rộng của bệnh. Di căn gan được cho là tiên lượng xấu. Nếu bệnh nhân có tình trạng hoạt động khởi đầu xấu gây ra bởi nền tảng của bệnh lý ác tính, những triệu chứng này thường không xuất hiện một cách nhanh chóng cùng lúc với điều trị, đưa đến kết quả của việc cải thiện thực tế là chất lượng cuộc sống. Tuy nhiên, sự suy chức năng cơ quan chính từ các nguyên nhân không phải bệnh lý ác tính thường đưa đến kết quả là bệnh nhân không có khả năng dung nạp hóa trị.
D/ ĐIỀU TRỊ.
Một số phác đồ hóa trị kết hợp sẵn có cho ung thư phổi tế bào nhỏ (bảng 7.6). Sự cải thiện về thời gian sống thêm không rõ ràng cho bất kỳ một phác đồ hóa trị nào khác đã được chứng minh. Với những phác đồ hóa trị này, tỷ lệ đáp ứng toàn bộ là từ 75% đến 90% và tỷ lệ đáp ứng hoàn toàn là 50% cho tình trạng bệnh còn khu trú có thể được đoán trước.
Đối với tình trạng bệnh ở giai đoạn lan tràn, tỷ lệ đáp ứng toàn bộ xấp xỉ 75% và tỷ lệ đáp ứng hoàn toàn thường là 25%. Mặc dầu có tỷ lệ đáp ứng cao, tuy nhiên thời gian sống thêm trung bình vẫn giữ ở mức xấp xỉ 14 tháng cho tình trạng bệnh khu trú và 7 đến 9 tháng cho tình trạng bệnh lan tràn. Có ít hơn 5% bệnh nhân với tình trạng bệnh ở giai đoạn lan tràn sống thêm trên 2 năm.

Như đã trình bày, hoặc Cisplatin hoặc Carboplatin, cùng với Etoposide là phác đồ điều trị chuẩn cho ung thư phổi tế bào nhỏ ở Bắc Mỹ. Trong một nghiên cứu ngẫu nhiên pha III ở Nhật Bản đã được công bố vào năm 2002, hóa trị 4 chu kỳ Irinotecan/ Cisplatin đã được so sánh với 4 chu kỳ Etoposide/ Cisplatin. Việc tuyển chọn bệnh nhân đã phải dừng lại sớm bởi vì sự phân tích tạm thời đang cho thấy lợi ích sống thêm rõ ràng ở nhánh nghiên cứu, với thời gian sống thêm trung bình là 12,8 tháng cho nhóm Irinotecan/Cisplatin so với 9,4 tháng cho nhóm Etoposide/Cisplatin. Thời gian sống thêm 1 năm và 2 năm cho 2 nhóm là 58% và 19,5% so với 38% và 5%. Một thử nghiệm ngẫu nhiên ở Mỹ cũng đã được thực hiện để chứng thực những kết quả này và gần đây đã được công bố. Nghiên cứu này chỉ định ngẫu nhiên những bệnh nhân ung thư phổi tế bào nhỏ giai đoạn lan tràn chưa được điều trị trước đó để nhận Etoposide/Cisplatin hoặc Irinotecan/Cisplatin và không có sự khác biệt về tỷ lệ đáp ứng, thời gian bệnh tiến triển hoặc sống thêm trung bình giữa hai nhánh điều trị. Những lý giải có khả năng tại sao có sự khác biệt từ nghiên cứu của người Nhật gồm có sự khác biệt về sinh học trong sự chuyển hóa và hoạt tính của thuốc giữa 2 quần thể nghiên cứu khác nhau và/hoặc khác nhau về liều lượng hoặc thời gian hóa trị giữa 2 nghiên cứu.
1/ Tăng cường liều.
Một phân tích tổng hợp về hóa trị tăng cường liều cho ung thư phổi tế bào nhỏ được đánh giá với những liều mà không yêu cầu ghép tủy nâng đỡ đã cho thấy không có sự tương thích giữa liều tăng cường và hiệu quả. Đã có một vài thử nghiệm lâm sàng pha I và II để đánh giá vai trò của công cụ tủy xương với những liều hóa trị tiếp theo sau việc thay thế tế bào gốc (ví dụ như ghép tủy tự thân) cho các kết quả sống thêm thất vọng. Trong một nghiên cứu ngẫu nhiên pha III, khi so sánh với liều hóa trị qui ước, hóa trị liều cao với việc lưu giữ tế bào mầm đã kéo dài thời gian sống thêm không tái phát, nhưng không kéo dài thời gian sống thêm toàn bộ.
2/ Thời gian điều trị.
Hầu hết các nghiên cứu ngẫu nhiên không cho thấy lợi ích về thời gian sống thêm khi kéo dài việc thực hiện hóa trị. Một vài nghiên cứu đã chứng minh không có lợi ích về thời gian sống thêm của việc kéo dài điều trị bước một hơn là điều trị tái phát. Sự chọn lựa thời gian điều trị cho ung thư phổi tế bào nhỏ là 4 đến 6 tháng.
3/ Điều trị bước 2.
Không có phác đồ điều trị triệt để cho những bệnh nhân có tình trạng bệnh tái phát đã được chứng thực. Chỉ có Topotecan đã được chấp thuận để điều trị bước 2 cho ung thư phổi tế bào nhỏ, với tỷ lệ đáp ứng từ 20% đến 40% ở những bệnh nhân ung thư phổi tế bào nhỏ “ nhạy cảm “
(những bệnh nhân đó là những người có bệnh tái phát sau 2 đến 3 tháng hoặc nhiều hơn sau điều trị bước 1), với thời gian sống thêm trung bình từ 22 đến 27 tuần. Đối với những bệnh nhân kháng trị (bệnh tiếp tục tiến triển hoặc trong vòng 3 tháng sau khi hoàn tất điều trị bước 1), tỷ lệ đáp ứng trong các nghiên cứu pha II chỉ trong khoảng 3% đến 11%. Thời gian sống thêm trung bình xấp xỉ 20 tuần. Các tác nhân khác gồm có Etoposide uống và việc kết hợp Cyclophosphamide, Doxorubicin và Vincristine đã được sử dụng với tỷ lệ đáp ứng thấp.
E/ HÓA TRỊ CỘNG VỚI XẠ TRỊ VÀO NGỰC.
Có nhiều nghiên cứu đã được thực hiện với hóa trị và xạ trị vào ngực ở những bệnh nhân ung thư phổi tế bào nhỏ giai đoạn khu trú. Đối lập với những kết quả được quy cho sự khác nhau về phác đồ hóa trị, thời gian hóa trị hợp nhất và xạ trị vào ngực (đồng thời, liên tiếp và phương thức kiểu “ sandwich”). Hai phân tích tổng hợp đã kết luận rằng xạ trị vào ngực cho kết quả không nhiều nhưng cải thiện có ý nghĩa về thời gian sống thêm và chủ yếu kiểm soát bệnh ở ngực mặc dầu không đưa ra những kết luận về việc thực hiện vấn đề chọn lựa theo thứ tự của hóa trị và xạ trị vào ngực. Trong một nghiên cứu ngẫu nhiên, xạ trị đa phân liều 2 lần mỗi ngày được so sánh với liều một lần mỗi ngày, cả hai được cho đồng thời với 4 chu kỳ Cisplatin và Etoposide. Thời gian sống thêm cao hơn có ý nghĩa ở phác đồ 2 lần mỗi ngày (sống thêm trung bình là 23 tháng so với 19 tháng, sống thêm 5 năm là 26% so với 16%), mặc dầu phải trả giá với viêm thực quản độ 3 nhiều hơn. Trong một thử nghiệm ngẫu nhiên khác, việc thực hiện sớm xạ trị vào ngực trong điều trị đa mô thức cho ung thư phổi tế bào nhỏ giai đoạn sớm thì tốt hơn so với thực hiện muộn hoặc xạ trị củng cố vào ngực. Những dữ liệu này gợi ý rằng, những bệnh nhân có tình trạng hoạt động tốt và bệnh còn khu trú thì nên nhận hóa xạ trị đồng thời, với đa phân liều 2 lần mỗi ngày được ưa thích hơn.
F/ XẠ TRỊ HỘP SỌ DỰ PHÒNG.
Hầu hết các thử nghiệm ngẫu nhiên đều thất bại để cho thấy rằng xạ trị não dự phòng làm gia tăng thời gian sống thêm nhưng đã chứng minh làm giảm nguy cơ di căn não mà không giảm chức năng tinh thần. Tuy nhiên, một phân tích tổng hợp trong 7 thử nghiệm ngẫu nhiên, xạ trị vào hộp sọ dự phòng đã cho thấy sự tăng lên có ý nghĩa thời gian sống thêm 3 năm với sự tăng thêm 5,4%. Nó cũng làm gia tăng thời gian sống thêm không bệnh và làm giảm nguy cơ phát sinh di căn não.
VI/ GIẢM NHẸ TRIỆU CHỨNG.
A/ Xạ trị.
Xạ trị giảm nhẹ triệu chứng thì thường hữu ích trong việc kiểm soát đau gây ra bởi di căn xương hoặc chức năng thần kinh cho những bệnh nhân có di căn não. Xạ trị vào ngực có thể giúp kiểm soát tình trạng khái huyết, hội chứng tĩnh mạch chủ trên, tắc nghẽn đường thở, chèn ép thần kinh thanh quản và các biến chứng tại chỗ khác.
B/ Tràn dịch màng phổi.
Các tác nhân gây xơ hóa thông thường gồm có Doxycycline, bột Talc và Bleomycin. Nhược điểm của Bleomycin là giá thành của nó, bột Talc, mặc dầu có hiệu quả nhưng nhược điểm là đòi hỏi phải soi lồng ngực và thường phải gây tê để bơm thuốc vào. Các thử nghiệm ngẫu nhiên để so sánh đang được thực hiện.
C/ Điều trị áp sát.
Đối với những bệnh nhân có chèn ép khí quản mà đã được nhận xạ trị ngoài liều tối đa, việc sử dụng xạ trị trong khí quản liều cao có lẽ có ích tạm thời.
D/ Suy mòn.
Megestrol acetate 160 đến 180 mg mỗi ngày có thể cải thiện sự ngon miệng cho một số bệnh nhân.
E/ Hóa trị.
Trong các thử nghiệm ngẫu nhiên bao gồm cả những bệnh nhân ung thư phổi không phải tế bào nhỏ và ung thư phổi tế bào nhỏ, hóa trị đã cho thấy làm giảm tần xuất các triệu chứng liên quan với ung thư chẵn hạn như đau, ho, khái huyết và thở ngắn.
F/ Nhóm các tác nhân kích thích.
Filgrastim (tác nhân kích thích nhóm bạch cầu hạt) làm giảm tần xuất sốt do giảm bạch cầu, thời gian truung bình giảm bạch cầu, số ngày nằm viện và số ngày điều trị kháng sinh cho bệnh nhân. Tuy nhiên, lợi ích lâm sàng của việc duy trì một phương thức điều trị với liều lượng lớn để điều trị cho các bệnh nhân ung thư phổi đã không được công bố. Thêm nữa, một sự thận trọng phải được thi hành khi sử dụng nhóm các tác nhân kích thích cho các bệnh nhân tiếp nhận điều trị đa mô thức với cả hóa trị và xạ trị vào ngực. Một nghiên cứu ngẫu nhiên của Nhóm ung thư Tây Nam (SWOG) những bệnh nhân đang tiếp nhận Sargramostim (nhóm tác nhân kích thích bạch cầu hạt- đại thực bào) và hóa trị đồng thời với xạ trị vào ngực đã làm gia tăng có ý nghĩa tình trạng giảm tiểu cầu hơn những bệnh nhân đang nhận đồng thời hóa trị và xạ trị mà không có yếu tố phát triển.
G/ Sự mệt mỏi.
Các chất kích thích như Methylphenidate (Ritalin) có lẽ có ích trong việc cải thiện sự mệt mỏi.- 21/09/2012 15:05 - Tế bào gốc trong phục hồi tim - Các tiến bộ gần đâ…
- 20/09/2012 21:41 - Vai trò siêu lọc máu trong Hồi Sức Tích Cực-Chống …
- 20/09/2012 08:58 - Ung thư thực quản
- 19/09/2012 08:40 - Phân độ X quang trong bệnh lý trào ngược bàng quan…
- 15/09/2012 09:51 - Statin - một nhóm thuốc hạ mỡ có tác dụng chống vi…
- 14/09/2012 21:02 - Hội chứng hoạt hóa đại thực bào
- 13/09/2012 20:59 - Một cách nhìn khác về cắt tầng sinh môn
- 12/09/2012 12:43 - Chấn thương ngực
- 08/09/2012 20:10 - Dự phòng huyết khối thuyên tắc ở bệnh nhân phẫu th…
- 04/09/2012 20:31 - Phương pháp xử trí tối ưu trên bệnh nhân sốc nhiễm…









